Ошибка.
Попробуйте повторить позже
На рисунке изображены два сосуда с влажным воздухом. Используя сведения, приведённые на рисунке, определите отношение массы водяных паров, содержащихся в сосуде 2, к массе водяных паров, содержащихся в сосуде 1.

Пусть – масса пара,
– объем сосуда,
– его температура,
– давление насыщенного пара,
– давление воздуха,
–
молярная масса воздуха.
Относительная влажность равна:
По уравнению Клапейрона–Менделеева:
Тогда:
Ошибка.
Попробуйте повторить позже
В закрытом сосуде объёмом 10 л при температуре +27 находится воздух, имеющий влажность 60%. Давление
насыщенных паров воды при этой температуре равно 2000 Па. Какую массу воды надо испарить в сосуде при данной
температуре для того, чтобы влажность воздуха стала равна 100%? Ответ выразите в миллиграммах и округлите до целого
числа.
Указание:округлять только в конечном расчёте
Запишем уравнение Менделеева-Клапейрона:
где — молярная масса газа,
— количество вещества,
— температура в Кельвинах,
— давление газа,
— объем,
занимаемый газом,
— масса пара,
— универсальная газовая постоянная.
Влажность можно найти по формуле:
где — давление газа,
— давление насыщенных паров. Давление насыщенных паров 100
равно
Па.
Изначальная масса пара в воздухе:
мг
Запишем уравнение Менделеева-Клапейрона при достижении давления насыщенного пара
где – количество пара.
Откуда
Значит, необходимо дополнительно испарить
Ошибка.
Попробуйте повторить позже
В вертикальном цилиндре с гладкими стенками под невесомым поршнем находится моль газа, занимающего объём
при температуре
К. С какой силой надо действовать на поршень перпендикулярно его поверхности, чтобы он
оставался неподвижным? Атмосферное давление
кПа , площадь поршня
. (Ответ дайте в
ньютонах.)
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Давление внутри сосуда:
Так как давление внутри больше атмосферного, то чтобы поршень находился в равновесии, необходимо действовать силой вниз, чтобы уравновесить силы:
Ошибка.
Попробуйте повторить позже
При некоторой температуре средняя квадратичная скорость молекулы кислорода равна 400 м/с. Какова при этой же температуре средняя квадратичная скорость атома гелия? (Ответ дайте в м/с и округлите до целых.)
Получим взаимосвязь среднеквадратичной скорости и температуры:
где — постоянная Больцмана.
Кинетическая энергия одной молекулы/атома по определению равна:
где — масса молекулы/атома,
— средняя квадратичная скорость молекулы/атома.
Количество вещества можно найти двумя способами:
где — молярная масса,
— число молекул/атомов,
— число Авогадро.
Приравняем (2) и (3) и выразим массу молекулы/атома:
По условию задачи = 1, следовательно:
Подставим (4) в (1):
С учетом того, что , получаем:
где — универсальная газовая постоянная. Записав эту формулу для двух случаев, получим соотношение:
где и
— средняя квадратичная скорость и молярная масса молекулы кислорода,
и
— средняя квадратичная
скорость и молярная масса атома гелия.
Выразим искомую величину:
Ошибка.
Попробуйте повторить позже
В некотором городе на заводе
имеется ртутная лампа объемом
, в которой содержатся пары ртути при
температуре
. Какую плотность имеет газ, если в сосуде содержится
молекул, которые имеют скорость 500 м/с? (Ответ
дайте в
и округлите до десятых.)
Cвязь температуры газа со средней кинетической энергией поступательного теплового движения его частиц:
Приравняем (1) к (2):
где — постоянная Больцмана,
— темпераутра газа в Кельвинах,
— масса одной молекулы газа,
— средний
квадрат скорости.
Выразим массу одной молекулы:
Масса газа равна:
где — количество молекул газа.
Заметим, что плотность газа рассчитывается по формуле:
Ошибка.
Попробуйте повторить позже
В сосуде содержится аргон под давлением 300 кПа. Концентрацию аргона уменьшили в 2 раза, а среднюю кинетическую энергию его молекул увеличили в 3 раза. Определите установившееся давление газа. Ответ дайте в кПа.
Давление газа можно найти по формуле:
где — концентрация вещества,
— постоянная Больцмана ,
— температура газа.
Связь кинетической энергии с температурой
Тогда
Так как концентрация уменьшается в 2 раза, а кинетическая энергия увеличивается в 3 раза, то давление увеличивается в 1,5 раза и будет равно 450 кПа.
Ошибка.
Попробуйте повторить позже
При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа увеличилась в 2,5 раза. Конечная температура газа равна 500 К. Какова начальная температура газа? Ответ дайте в К.
Кинетическая энергия движения молекул газа:
где — постоянная Больцмана,
— температура газа в кельвинах.
Тогда искомая начальная температура в 2,5 раза меньше конечной температуры и составляет 200 К.
Ошибка.
Попробуйте повторить позже
Во сколько раз увеличится давление разреженного одноатомного газа, если при увеличении концентрации молекул газа в 3 раза его абсолютная температура увеличится в 2 раза?
Давление газа можно найти по формуле:
где — концентрация вещества,
— постоянная Больцмана ,
— температура газа.
Если концентрация увеличивается в 3 раза, а температура в 2 раза, то давление увеличивается в 6 раз.
Ошибка.
Попробуйте повторить позже
В сосуде неизменного объёма находится идеальный газ в количестве 1 моль. Во сколько раз увеличится давление газа на стенки сосуда, если добавить в сосуд ещё 3 моль того же газа, а абсолютную температуру газа уменьшить в 2 раза?
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Если добавить 3 моля газа, то количество вещества увеличится в 4 раза, при уменьшении температуры в 2 раза давление увеличится
в 2 раза.
Ошибка.
Попробуйте повторить позже
Идеальный газ, находящийся в сосуде под поршнем, переходит из состояния 1 в состояние 2 (см. рис.). Количество вещества газа не
меняется. Найдите отношение .
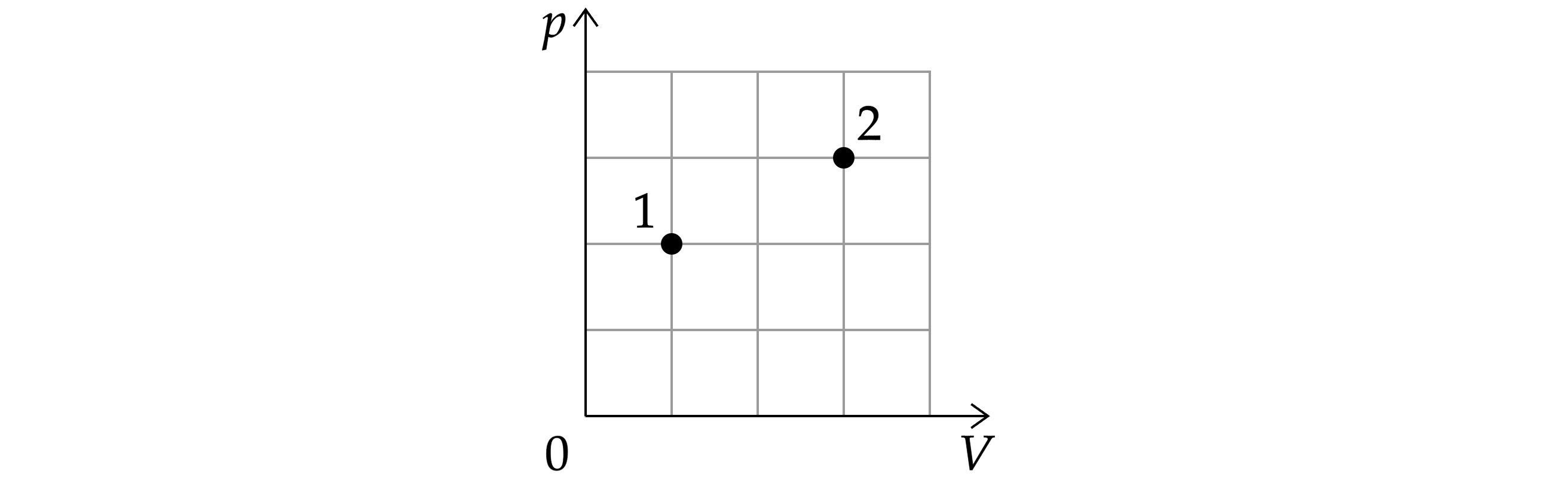
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Тогда
Ошибка.
Попробуйте повторить позже
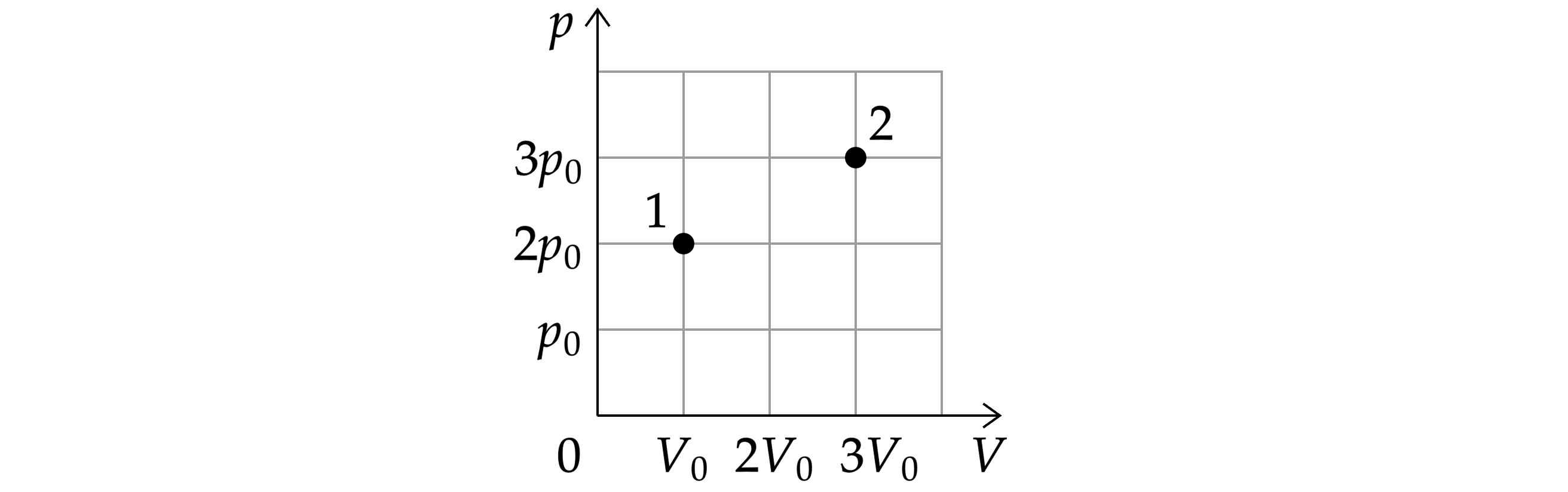
Идеальный газ, находящийся в сосуде под поршнем, переходит из состояния 1 в состояние 2 (см. рис.). Количество вещества газа не
меняется. Найдите отношение .


Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Тогда
Ошибка.
Попробуйте повторить позже
На рисунке показан график изменения давления постоянной массы разреженного газа при изохорном нагревании. Объем газа равен
0,2 м. Чему равно число молей газа? Ответ округлите до целых.
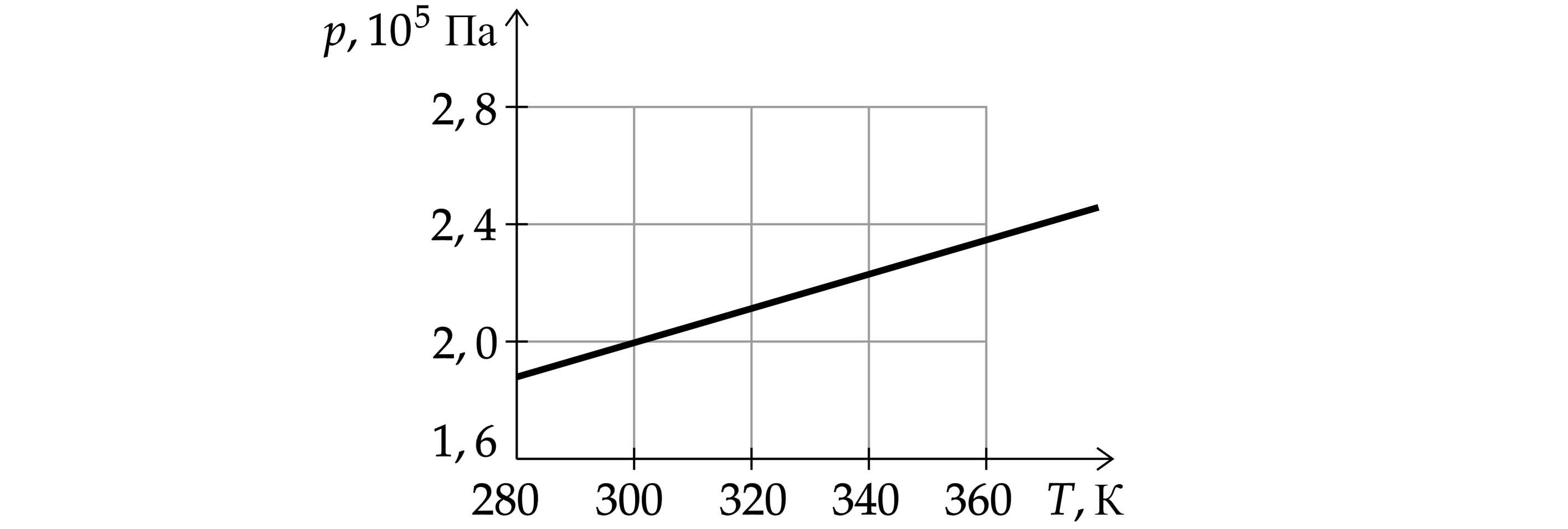
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Для точки Па и
К имеем
Ошибка.
Попробуйте повторить позже
Абсолютная температура воздуха в сосуде понизилась в 1,5 раза, при этом воздух перешел из состояния 1 в состояние 2 (см. рис.).
Сквозь неплотно закрытый кран сосуда мог просачиваться воздух. Рассчитайте отношение - числа молекул газа в сосуде в
конце и начале опыта. Воздух считать идеальным газом.
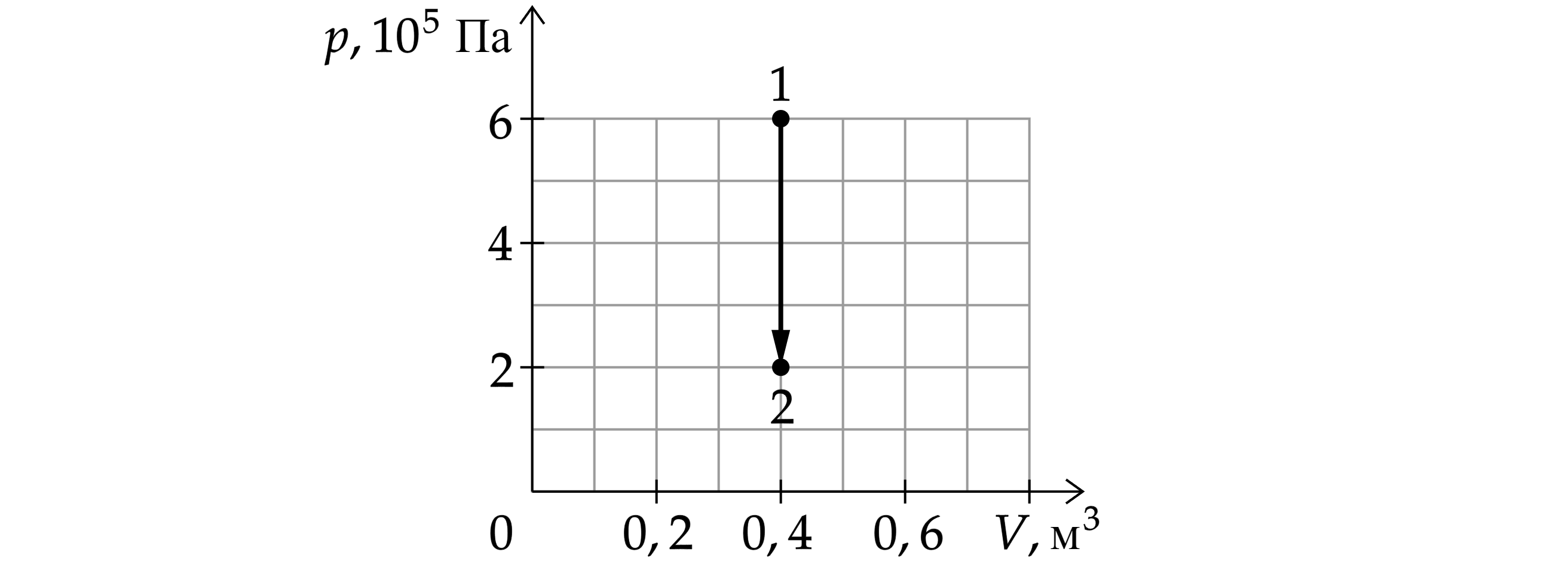
Запишем формулу для расчета давления газа:
где — это концентрация газа,
— постоянная Больцмана,
— температура газа в Кельвинах.
Концентрация равна
где – объём газа.
Тогда
Отсюда
Ошибка.
Попробуйте повторить позже
Давление 1 моль водорода в сосуде при абсолютной температуре равно 100 кПа. Сколько моль кислорода в этом сосуде создадут
давление 300 кПа при вдвое большей абсолютной температуре? Ответ дайте в молях.
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Давление увеличивается в 3 раза, а температура в 2 раза, значит, количество вещества должно увеличится в 1,5
раза
Ошибка.
Попробуйте повторить позже
Относительная влажность воздуха увеличилась с 30% до 60% при неизменной температуре. Во сколько раз увеличилась при этом концентрация водяных паров в воздухе?
Относительная влажность прямо пропорциональна концентрации, значит, концентрация увеличилась в 2 раза.
Ошибка.
Попробуйте повторить позже
На рисунке показан график процесса, проведённого над 2 моль газообразного аргона. Найдите отношение абсолютных температур
.
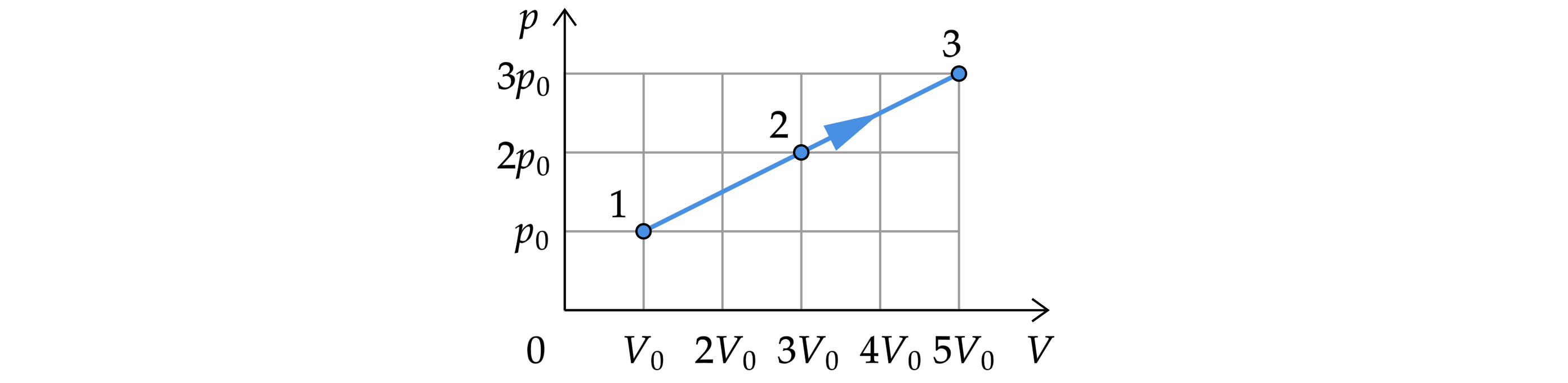
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Искомое соотношение:
Ошибка.
Попробуйте повторить позже
Цилиндрический сосуд с гладкими стенками разделён лёгким подвижным поршнем на две части. В одной части сосуда находится неон, в другой – аргон. Температуры газов одинаковы. Определите отношение концентрации молекул неона к концентрации молекул аргона в равновесном состоянии.
Давление газа можно найти по формуле:
где — концентрация вещества,
— постоянная Больцмана ,
— температура газа.
Так как поршень подвижный и лёгкий, то давление газов одинаково. По условию также одинакова температура, значит,
концентрация газов одинакова и их отношение равно 1.
Ошибка.
Попробуйте повторить позже
На рисунке представлен график зависимости объёма идеального газа от его температуры в некотором процессе. В состоянии 1 давление газа было равно нормальному атмосферному давлению. Какое давление соответствует состоянию 2, если масса газа остаётся неизменной? Ответ дайте в кПа.
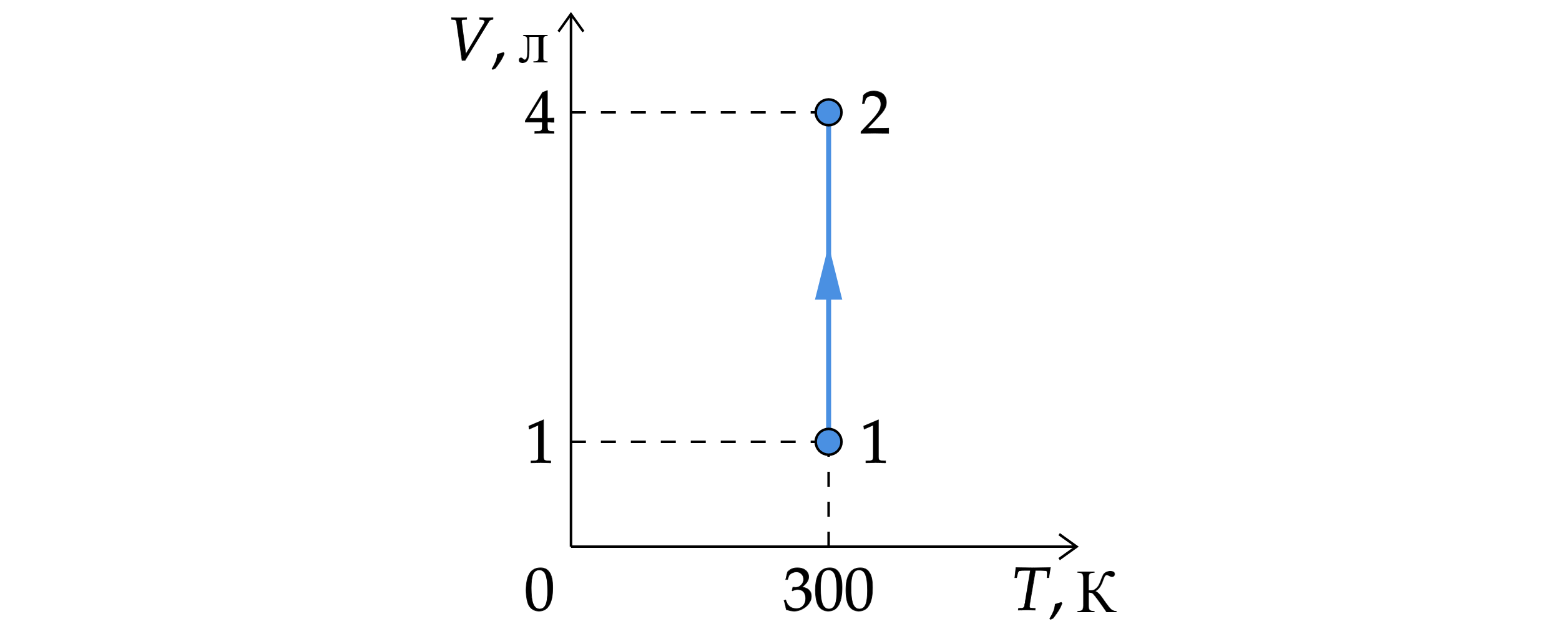
По закону Бойля – Мариотта:
тогда искомое давление
Ошибка.
Попробуйте повторить позже
При увеличении абсолютной температуры средняя кинетическая энергия хаотического теплового движения молекул разреженного одноатомного газа увеличилась в 2 раза. Конечная температура газа равна 600 К. Какова начальная температура газа? Ответ дайте в К.
Взаимосвязь изменения кинетической энергии и температуры:
где — постоянная Больцмана.
При увеличении энергии в 2 раза, температура увеличится в 2 раза. Следовательно, конечная температура газа
равна:
Ошибка.
Попробуйте повторить позже
Температура неона увеличилась с до
. Во сколько раз увеличилась средняя кинетическая энергия теплового движения
его молекул?
Связь кинетической энергии с температурой
где – температура в Кельвинах.
Начальная температура К, конечная
К. Отношение температур равно двум, значит,
кинетическая энергия увеличилась в 2 раза.



