Ошибка.
Попробуйте повторить позже
На pV-диаграмме показаны два процесса, проведённые с одним и тем же количеством газообразного аргона. Из приведённого ниже списка выберите все верные утверждения, характеризующие процессы на графике.
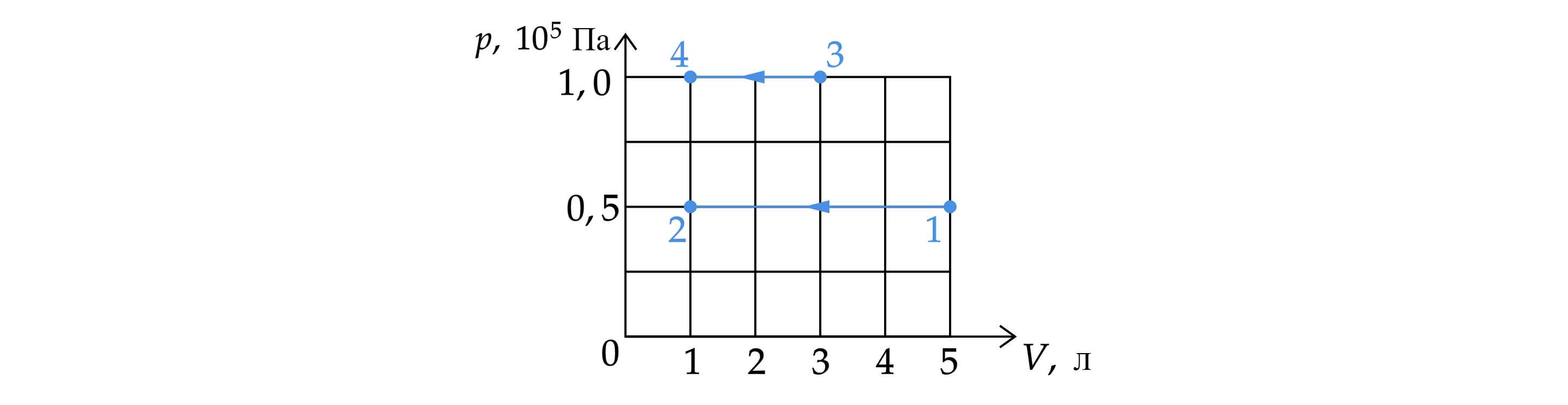
1) Работа, совершённая внешними силами над аргоном, в процессах 1–2 и 3–4 одинакова.
2) В процессе 3–4 абсолютная температура аргона изобарно уменьшилась в 5 раз.
3) В процессе 1–2 давление аргона в 2 раза больше, чем в процессе 3–4.
4) В процессе 1–2 аргон изобарно увеличил свой объём на 4 л.
5) В процессе 1–2 внутренняя энергия аргона уменьшилась в 5 раз.
1)
Работа над газом в изобарном процессе:
Тогда для первого и второго процесса:
То есть работа над газом в обоих процессах одинакова.
2)
Из закона Менделеева-Клапейрона для постоянного количества газа:
где – температура,
– количество вещества,
– универсальная газовая постоянная.
Так как давление постоянно, а объём газа уменьшается в 3 раза, то температура также уменьшается в 3 раза.
3)
Нет, по графику давление в 1-2 в раза меньше, чем в процессе 3-4.
4)
Нет, объём уменьшается на 4 л.
5)
Из закона Менделеева-Клапейрона для постоянного количества газа:
где – температура,
– количество вещества,
– универсальная газовая постоянная.
Так как давление постоянно, а объём газа уменьшается в 5 раза, то температура также уменьшается в 5 раза.
Внутренняя энергия равна
так как температура уменьшилась в 5 раз, то и внутренняя энергия уменьшается в 5 раз.
Ошибка.
Попробуйте повторить позже
1 моль одноатомного идеального газа совершает цикл 1-2-3-1, при котором давление газа изменяется с изменением плотности
газа так, как показано на рисунке. Значения плотности и давления в вершинах цикла представлены на графике. Выберите из
предложенного перечня все верные утверждения.
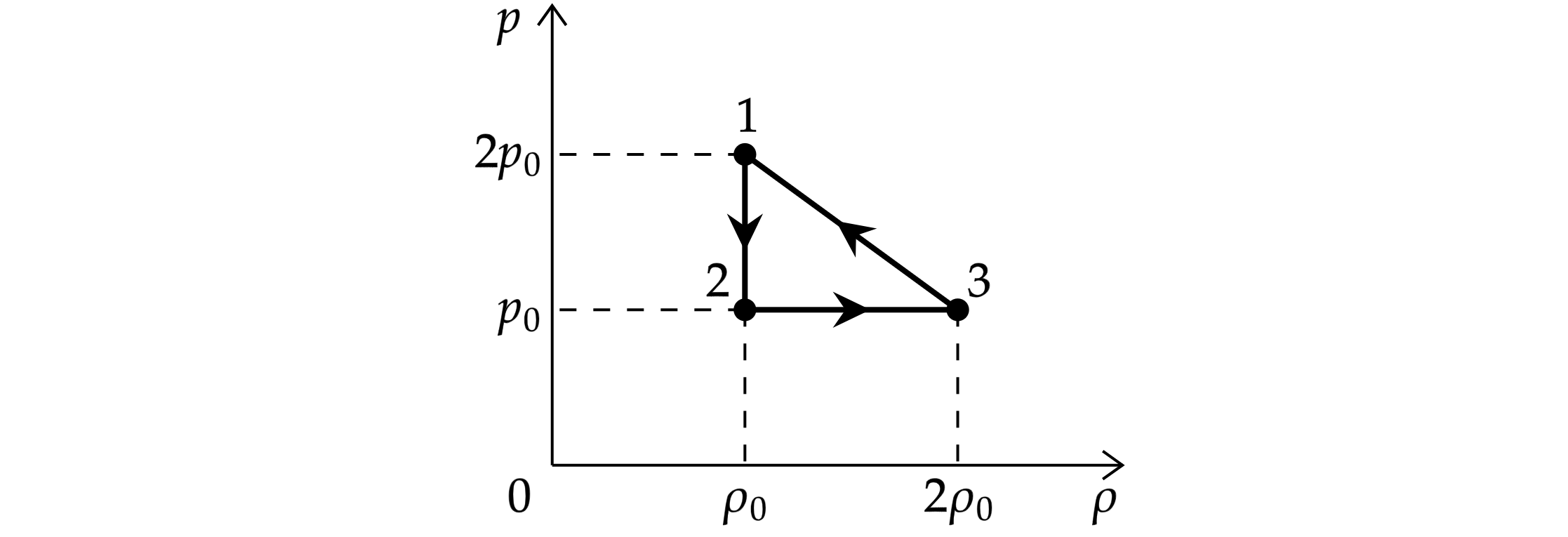
1) Работа газа в процессе 1-2 равна нулю.
2) В процессе 3-1 газ отдаёт положительное количество теплоты.
3) Температура газа в состоянии 3 минимальна.
4) Внутренняя энергия газа в процессе 2-3 увеличивается.
5) При переходе газа из 3 в 1 внутренняя энергия не меняется.
1)
Плотность газа найдем по формуле , где
– масса,
– объём газа.
Работа газа пропорциональна изменению объёма газа, так как в процессе 1-2 плотность постоянна, то изменение объёма рана нулю,
то и работа газа равна нулю.
2)
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Внутренняя энергия равна:
где — количество вещества газа,
— универсальная газовая постоянная,
— абсолютная температура газа.
В процессе 3–1 плотность газа уменьшается, а объем увеличивается. Следовательно, работа газа на этом участке
положительна.
Запишем уравнение Менделеева – Клапейрона:
где — давление газа,
— объем, занимаемый газом.
Тогда
Для точек 3 и 1
То есть газ получает положительное количество теплоты.
3)
Из уравнения Клапейрона-Менделеева
где – молярная масса газа.
Отсюда
То есть температура в состоянии 3 минимальна.
4)
То есть внутренняя энергия уменьшается.
5)
См. пункт 2.
Ошибка.
Попробуйте повторить позже
На рисунке показаны два процесса, проведённых с одним и тем же количеством газообразного неона ( – давление неона;
– его
объём).
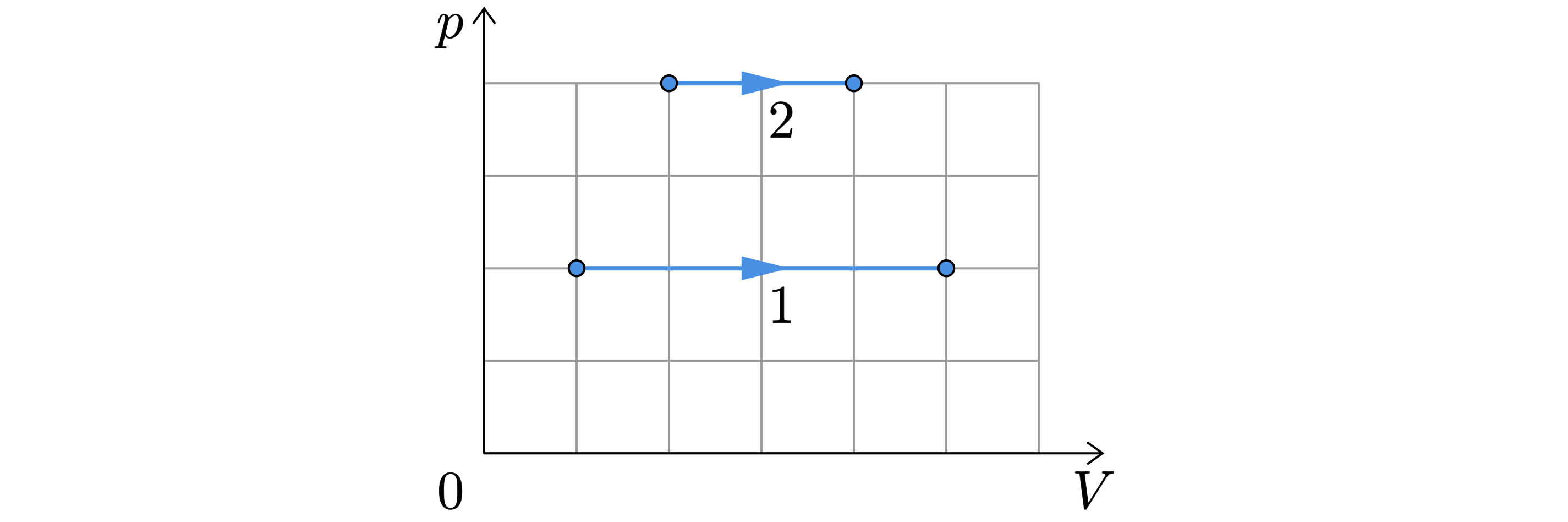
Из приведённого ниже списка выберите все верные утверждения, характеризующие процессы на рисунке.
1) В процессе 2 абсолютная температура неона изобарно увеличилась в 2 раза.
2) В процессе 1 плотность неона увеличилась в 5 раз.
3) В процессе 1 неон изобарно увеличил свой объём в 5 раз.
4) В процессе 2 концентрация молекул неона увеличилась в 2 раза.
5) Работа, совершенная неоном в процессе 1, больше, чем в процессе 2.
1)
Из закона Менделеева-Клапейрона для постоянного количества газа:
где – температура,
– количество вещества,
– универсальная газовая постоянная.
Так как давление равно, а объём газа увеличился в 2 раза, то температура также увеличилась в 2 раза.
2)
Плотность равна:
где – масса газа.
Так как объем увеличился в 5 раз, то плотность уменьшилась в 5 раз.
3)
Да, объём увеличился в 5 раз.
4)
Концентрация:
где – количество молекул.
То есть при увеличении объёма в 2 раза концентрация уменьшилась в 2 раза.
5)
Работа газа в изобарном процессе:
Тогда для первого и второго процесса:
То есть работа газа в обоих процессах одинакова.
Ошибка.
Попробуйте повторить позже
На рисунке показаны два процесса, проведённых с одним и тем же количеством газообразного неона ( – давление неона;
– его
объём).
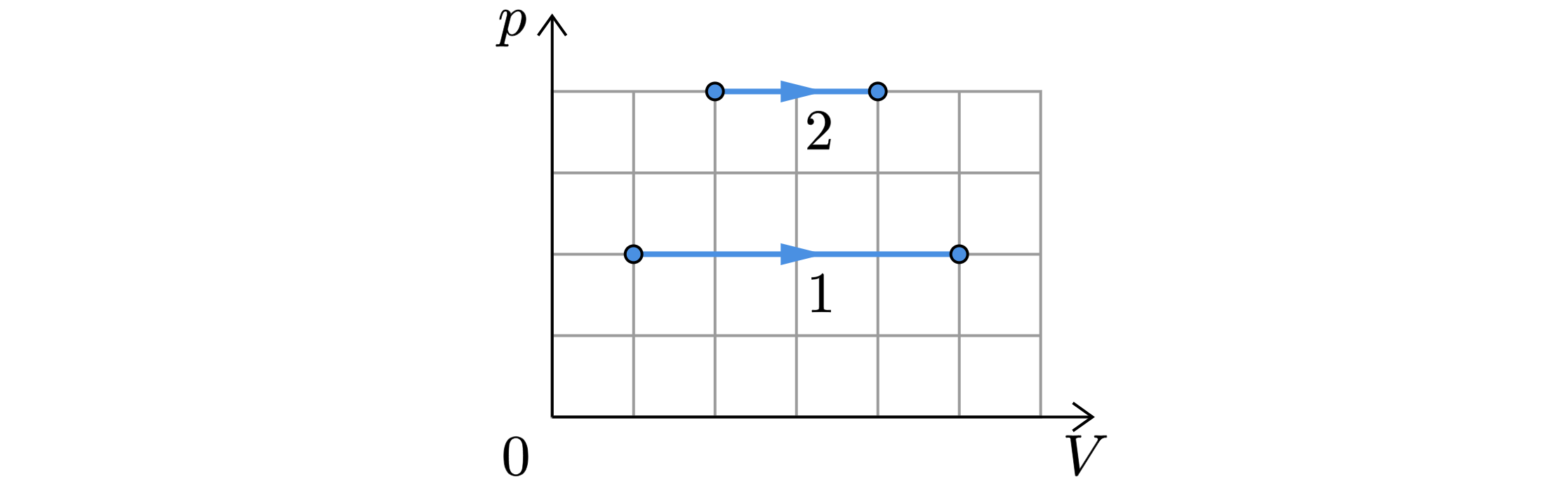
Из приведённого ниже списка выберите все верные утверждения, характеризующие процессы на рисунке.
1) В процессе 2 абсолютная температура неона изобарно увеличилась в 2 раза.
2) В процессе 1 плотность неона увеличилась в 5 раз.
3) Работа, совершённая неоном, в обоих процессах одинакова.
4) В процессе 1 объём неона изобарно увеличился в 4 раза.
5) В процессе 2 концентрация молекул неона уменьшилась в 2 раза.
1)
Из закона Менделеева-Клапейрона для постоянного количества газа:
где – температура,
– количество вещества,
– универсальная газовая постоянная.
Так как давление равно, а объём газа увеличился в 2 раза, то температура также увеличилась в 2 раза.
2)
Плотность равна:
где – масса газа.
Так как объем увеличился в 5 раз, то плотность уменьшилась в 5 раз.
3)
Работа газа в изобарном процессе:
Тогда для первого и второго процесса:
То есть работа газа в обоих процессах одинакова.
4)
Нет, объём увеличился в 5 раз.
5)
Концентрация:
где – количество молекул.
То есть при увеличении объёма в 2 раза концентрация уменьшилась в 2 раза.
Ошибка.
Попробуйте повторить позже
На рисунке показан процесс изменения состояния одного моля одноатомного идеального газа ( – внутренняя энергия газа;
–
его давление). Используя данные графика, выберите из предложенного перечня все верные утверждения и укажите их
номера.
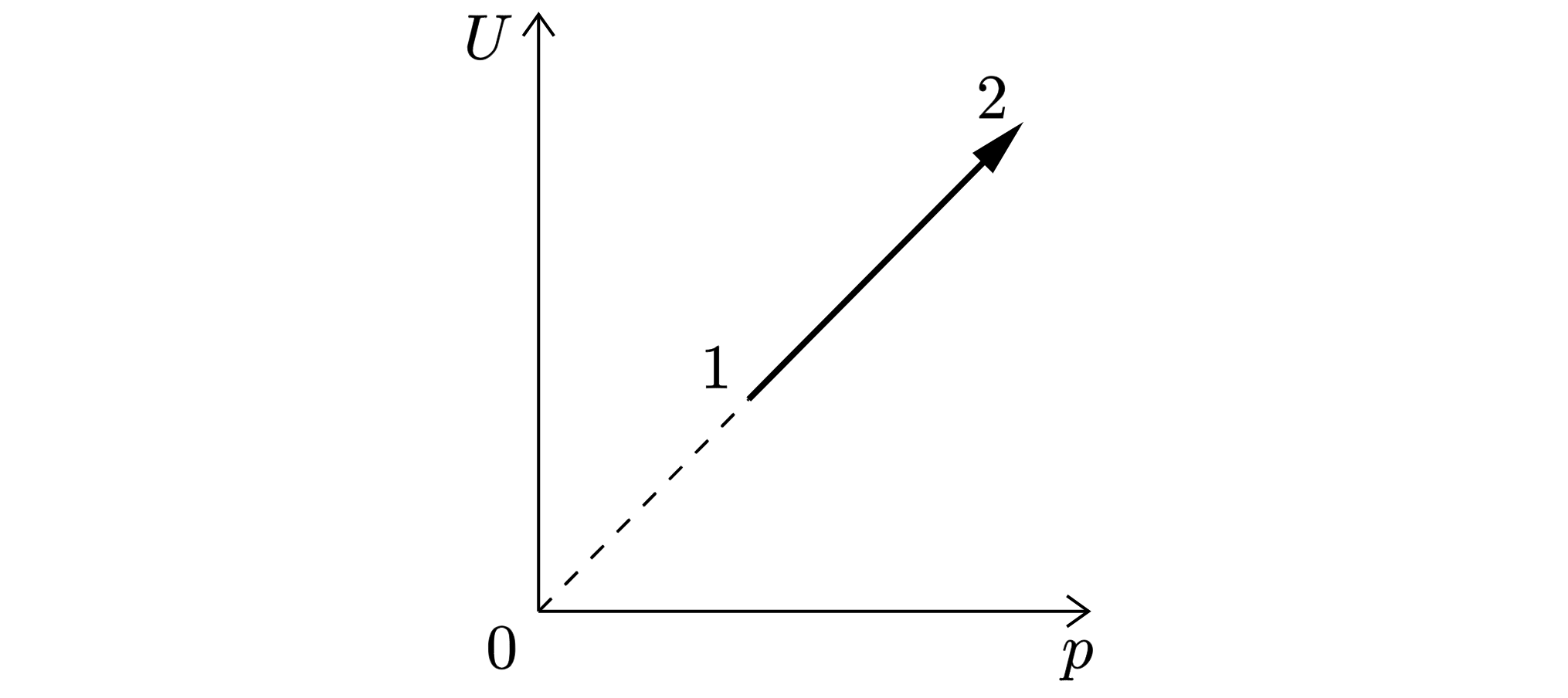
1) Концентрация молекул газа в ходе процесса уменьшается.
2) Объём газа в этом процессе остаётся неизменным.
3) Плотность газа в этом процессе увеличивается.
4) В ходе процесса газ расширяется.
5) Температура газа в ходе процесса повышается.
1)
, значит,
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Отсюда
То есть объём постоянен. Так как объем и масса газа остается неизменными, то концентрация не меняется.
2)
Да, см. пункт 1
3)
Плотность равна:
где – масса газа.
По условию масса газа постоянна, а из пункта 1 объём газа постоянен, значит, плотность не изменяется.
4)
Нет см. пункт 1
5)
Да, см. пункт 1.
Ошибка.
Попробуйте повторить позже
При изучении явления теплообмена герметичный теплоизолированный сосуд с одноатомным идеальным
газом разделили неподвижной перегородкой, способной проводить тепло, на две одинаковые части (см.
рисунок). После этого газ в разных частях сосуда нагрели до разных температур. Температура газа в
части А равна 303 К, а в части Б равна . Количество газа одинаково в обеих частях
сосуда. Считая, что теплоёмкость сосуда пренебрежимо мала, выберите все утверждения,
которые верно отражают изменения, происходящие с газом в дальнейшем после окончания
нагревания.
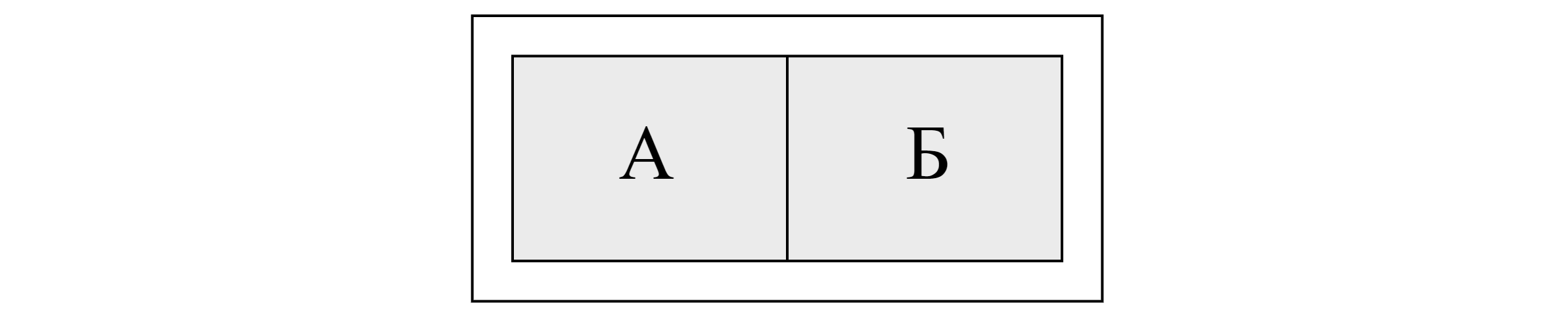
1) При теплообмене газ в части Б отдавал положительное количество теплоты, а газ в части А его получал.
2) Через достаточно большой промежуток времени температура газа в обеих частях сосуда стала одинаковой и равной 298 К.
3) Внутренняя энергия газа в части А не изменилась.
4) В результате теплообмена газа в сосуде А совершил работу.
5) Температура газа в части Б повысилась.
Найдём температуру части Б в Кельвинах К.
1)
Количество теплоты отдаёт газ с более высокой температурой, то есть газ в части А.
2)
Так как теплоёмкость сосуда пренебрежимо мала, то закон сохранения энергии газа запишется в
виде:
где – количество вещества,
и
– температуры в секциях А и Б соответственно,
–
конечная температура.
Тогда:
3)
Внутренняя энергия:
так как изменилась температура , то и изменилась и энергия.
4)
Перегородка неподвижна, объём не изменяется, значит, газ не совершает работу.
5)
Да, повысилась до 298 К.
Ошибка.
Попробуйте повторить позже
Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. Перегородка может пропускать атомы гелия и является непроницаемой для атомов аргона. В начале в левой части сосуда содержится 8 г гелия, а в правой – 1 моль аргона. Температура газов одинакова и остаётся постоянной. Выберите все верные утверждения, описывающие состояние газов после установления равновесия в системе. Запишите цифры, под которыми они указаны.
1) Внутренняя энергия гелия в сосуде больше, чем внутренняя энергия аргона.
2) Концентрация гелия и аргона в правой части сосуда одинакова.
3) В правой части сосуда общее число молекул газов в 2 раза меньше, чем в левой части.
4) Внутренняя энергия гелия в сосуде в конечном состоянии больше, чем в начальном.
5) Давление в обеих частях сосуда одинаково.
Демоверсия, 2022
1)
Внутрення энергия равна:
где – количество вещества,
– температура газа.
Количество гелия равно:
Так как количество вещества слева больше, то и внутренняя энергия больше.
2)
Перегородка проницаема только для молекул гелия, поэтому в результате установления равновесия
парциальное давление гелия в левой части будет равно парциальному давлению гелия в правой части.
Давление газа можно вычислить по формуле:
Парциальные давления гелия в левой и правой части одинаковы, одинаковы температуры и объёмы частей, следовательно, одинаковы и количества вещества гелия в левой и правой частях сосуда, то есть в левой и правой части сосуда будет содержаться по 1 моля гелия.
Найдём связь концентрации и количества вещества:
То есть концентрации и количества вещества зависят прямо пропорционально друг от друга, так как
справа количество вещества газов одинаково, то и концентрация одинакова.
3)
Нет, справа 2 моля, а слева 1 моль
4)
Нет, температура не изменяется.
5)
Из закона Менделеева-Клапейрона:
так как количество вещества разные, то и давления разные
Ошибка.
Попробуйте повторить позже
На рисунке показан график циклического процесса, проведённого с одноатомным идеальным газом, в
координатах , где
– объём газа,
–абсолютная температура газа. Количество вещества газа
постоянно.
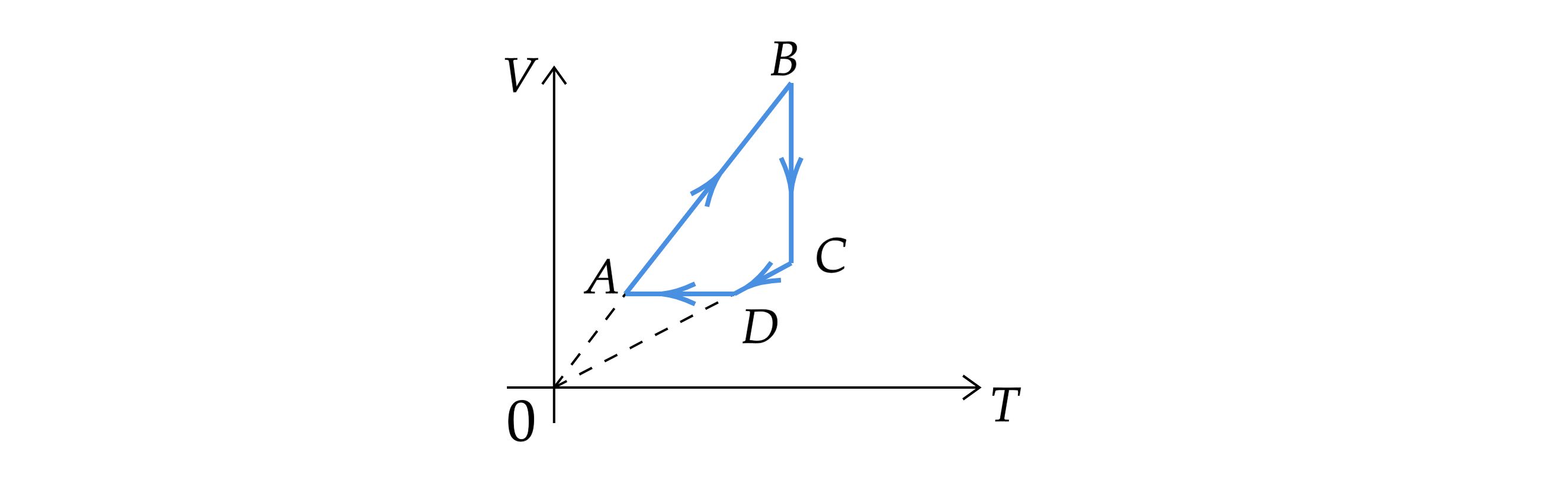
Из приведённого ниже списка выберите все верные утверждения, характеризующие отражённые на графике процессы.
1) Давление газа в процессе CD постоянно, при этом внешние силы совершают над газом положительную работу.
2) В процессе DA давление газа изохорно уменьшается.
3) В процессе АВ газ отдаёт в окружающую среду положительное количество теплоты.
4) В состоянии концентрация атомов газа максимальна
5) В процессе ВС внутренняя энергия газа остается постоянной.
Проанализируем процессы и
, в них объём и температура связаны линейно.
Запишем уравнение Менделеева-Клапейрона:
Отсюда
1)
Объём газа уменьшается на участке
2)
По закону Шарля:
3)
Запишем первое начало термодинамики:
При этом
4)
Концентрация равна:
Так как в точке
5)
Внутренняя энергия газа равна
Ошибка.
Попробуйте повторить позже
На рисунках А и Б приведены графики двух процессов: 1-2 и 3-4, в каждом из которых участвует 1 моль гелия. Графики построены в координатах V-T и p-V, где p – давление, V – объём и T – абсолютная температура газа.

УТВЕРЖДЕНИЯ
1) Газ получает положительное количество теплоты, при этом его внутренняя энергия увеличивается.
2) Газ получает положительное количество теплоты, при этом его внутренняя энергия не изменяется.
3) Над газом совершают положительную работу, при этом его внутренняя энергия уменьшается.
4) Над газом совершают положительную работу, при этом он получает положительное количество теплоты.
Установите соответствие между графиками и утверждениями, характеризующими изображённые на графиках процессы.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
А) По первому началу термодинамики:
Процесс 3-4 изобарный с уменьшением объёма, значит,
По закону Гей-Люссака:
Изменение внутренней энергии равно:
То есть
Б) Процессе 1-2 изотермический
Ошибка.
Попробуйте повторить позже
При изучении процессов, происходящих с гелием, ученик занёс в таблицу результаты измерения температуры и давления одного и того же количества газа в различных равновесных состояниях.
Какие из утверждений, приведённых ниже, соответствуют результатам этих опытов? Газ считать идеальным.
1) Внутренняя энергия газа в состоянии 6 в 3 раза больше, чем в состоянии 5.
2) При переходе от состояния 2 к состоянию 3 в ходе изотермического процесса газ совершил положительную работу.
3) В состояниях 1-3 объём газа был одинаковым.
4) При переходе от состояния 5 к состоянию 6 в ходе изохорного процесса газ получил положительное количество теплоты.
5) Объём газа в состоянии 4 в 2 раза меньше объёма газа в состоянии 1.
1)
Внутрення энергия равна:
в состоянии 6 температура равна
Так как процесс изотермический, то по закону Бойля-Мариотта:
3)
Нет, по закону Бойля-Мариотта (см. пункт 2) объём изменялся.
4)
По первому началу термодинамики:
Так как процесс изохорный, то
Тогда
5)
Из закона Бойля-Мариотта:
Ошибка.
Попробуйте повторить позже
С идеальным газом происходит циклический процесс 1-2-3-4-1, pV-диаграмма которого представлена на рисунке. Максимальная температура, достигаемая газом в этом процессе, составляет 400 K. На основании анализа этого циклического процесса выберите все верные утверждения.
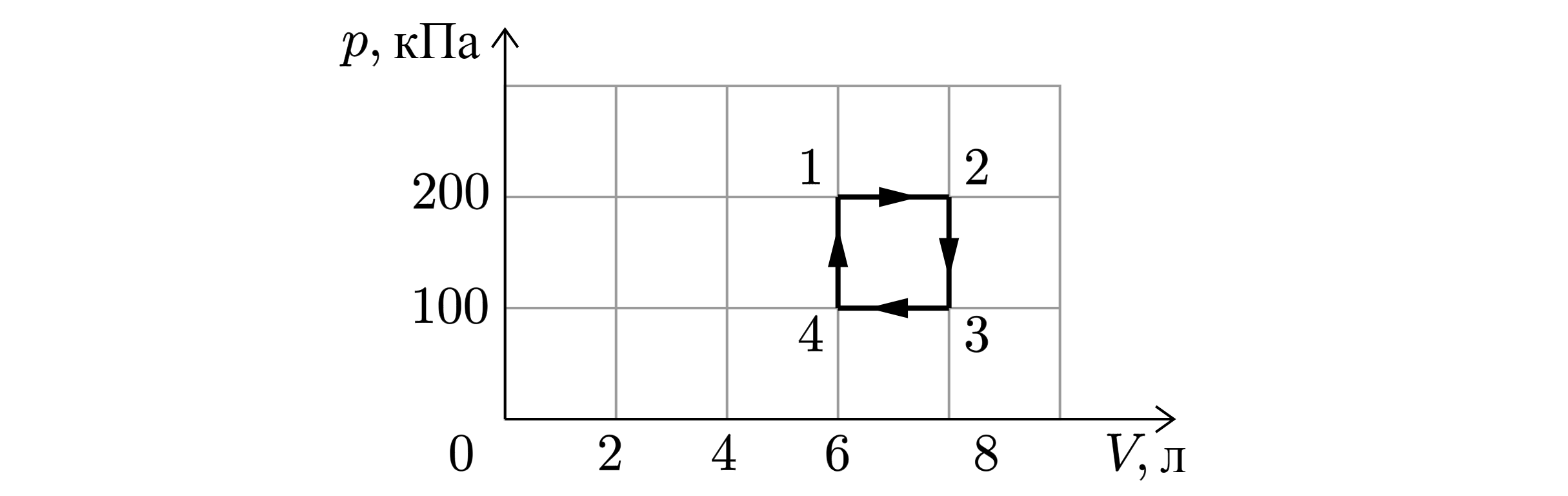
1) Количество вещества газа, участвующего в циклическом процессе, превышает 0,5 моля.
2) Работа газа при его изобарном расширении равна 400 Дж.
3) Работа, совершённая над газом при его изобарном сжатии, равна 100 Дж.
4) На участке 2-3 газ отдаёт положительное количество теплоты.
5) Минимальная температура газа в циклическом процессе равна 100 K.
Запишем уравнение Менделеева-Клапейрона:
Отсюда температура:
1)
Из уравнения Менделеева-Клапейрона:
Изобарное расширение 1-2, работу можно найти как площадь под графиком:
Изобарное сжатие 3-4, работу можно найти как площадь под графиком:
Запишем первое начало термодинамики:
В процессе 2-3 объём постоянен, значит, работа газа равна нулю.
При этом
5)
Из уравнения Менделеева-Клапейрона минимальная температура будет в точке 4, при этом
Ошибка.
Попробуйте повторить позже
На pV-диаграмме представлен цикл идеальной тепловой машины (цикл Карно), совершаемый с постоянным количеством идеального газа.
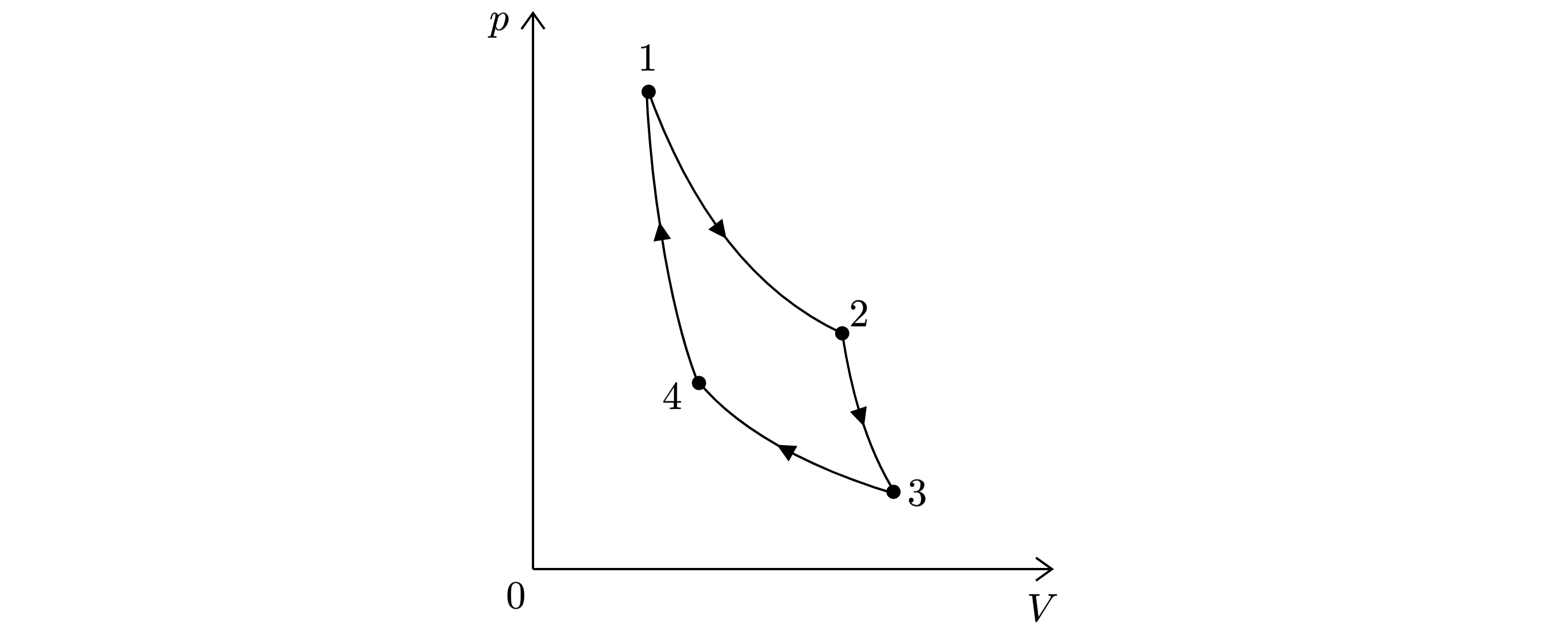
Из приведённого ниже списка выберите все правильные утверждения.
1) Процессы 2-3 и 4-1 являются изотермическими.
2) Процессы 2-3 и 4-1 являются адиабатическими.
3) В процессе 3-4 газ не совершает работы.
4) В процессе 2-3 газ отдает некоторое количество теплоты.
5) В процессе 1-2 газ получает некоторое количество теплоты.
1)
Цикл Карно состоит из двух изотерм и двух адиабат, при этом адиабата идёт "круче чем изотерма, то есть 2-3 и 4-1
адиабата.
2)
Цикл Карно состоит из двух изотерм и двух адиабат, при этом адиабата идёт "круче чем изотерма, то есть 2-3 и 4-1
адиабата.
3)
Газ не совершает работы только при изохорном процессе, а 3-4 – изотермический процесс.
4)
Процесс 2-3 является адиабатным, значит, газ не обменивается теплом со внешней средой.
5)
1-2 – изотермическое расширение, значит, работа газа положительна, при этом из-за постоянства температуры внутренняя энергия
газа не изменилась, значит, по первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Газ получает положительное количество теплоты
Ошибка.
Попробуйте повторить позже
На pV-диаграмме показан циклический процесс, состоящий из двух изохор и двух адиабат. В качестве рабочего вещества используется одноатомный идеальный газ.
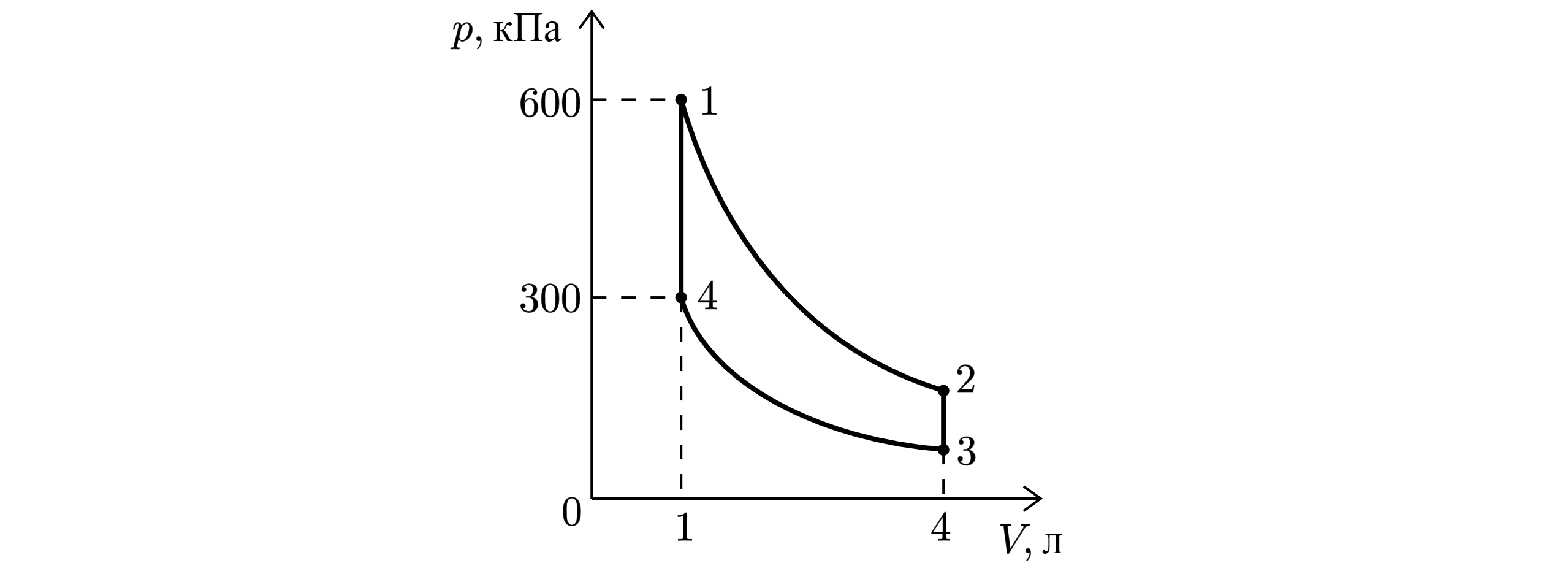
Из приведённого ниже списка выберите все правильные утверждения.
1) Данный цикл соответствует циклу идеальной тепловой машины (циклу Карно).
2) В процессе 4-1 газ получил количество теплоты 450 Дж.
3) В процессе 2-3 газ отдал в 4 раза большее количество теплоты, чем получил в процессе 4-1.
4) Внутренняя энергия газа в процессе 1-2 уменьшается.
5) В процессах 1-2 и 3-4 газ не совершает работы.
1)
Цикл Карно состоит из двух изотерм и двух адиабат, а в данном цикле 2 изохоры и 2 адиабаты.
2)
По первому закону термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Так как процесс 4-1 изохора, то работа газа равна нулю, а изменение внутренней энергии с учетом уравнения
Менделеева-Клапейрона:
3)
Процессы 2-3 и 4-1 изохорные, поэтому
При этом , но
, то есть
4)
При адиабатическом процессе:
а так как в процессе 1-2 газ расширяется, то и
5)
Объём газа в процессах 1–2 и 3–4 изменяется, а значит, газом или над газом совершается работа.
Ошибка.
Попробуйте повторить позже
Один моль идеального одноатомного газа переходит из состояния 1 в состояние 2 так, как показано на -диаграмме. На
основании анализа этого графика выберите все верные утверждения. 1 атм
Па.
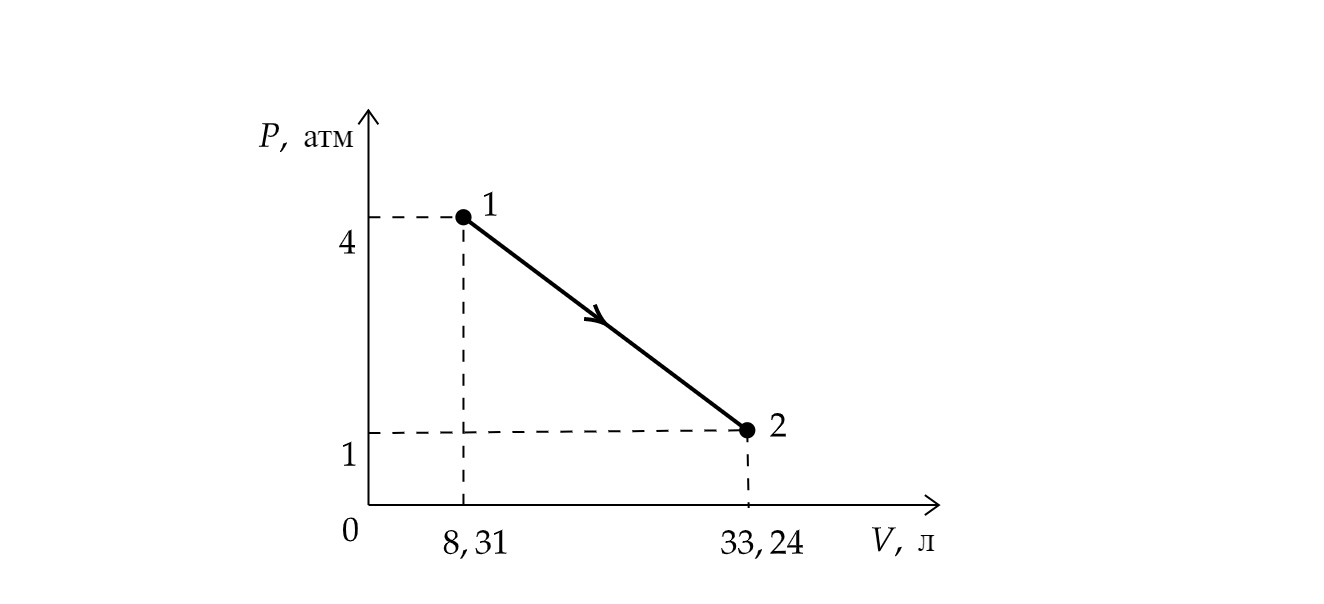
1) В состоянии, соответствующем точке 1, температура газа равна 400К.
2) В процессе 1-2 внутренняя энергия газа все время уменьшается.
3) В процессе 1-2 газ совершает работу 6232,5 Дж.
4)В состоянии, соответствующем точке 2, плотность газа достигает минимального значения в течение процесса 1-2.
5) В процессе 1-2 температура газа все время уменьшается.
1)
Найдем температуру из уравнения Менделеева-Клапейрона:
2)
Точки 1 и 2 лежат на одной изотерме, но процесс 1-2 не является изотермическим. При проведении изотерм через точки графика
видно, что сначала температура увеличивается, а после уменьшается.
3)
Работу найдем как площадь под графиком функции: Дж.
4)
Плотность газа найдем по формуле , в точке 2 газ имеет наибольший объем, при этом масса газа не изменяется, значит в
точке 2 газ имеет наименьшую плотность.
5)
см. пункт 2.
Ошибка.
Попробуйте повторить позже
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах , где
— объем газа,
— абсолютная температура. Количество вещества газа остается неизменным.
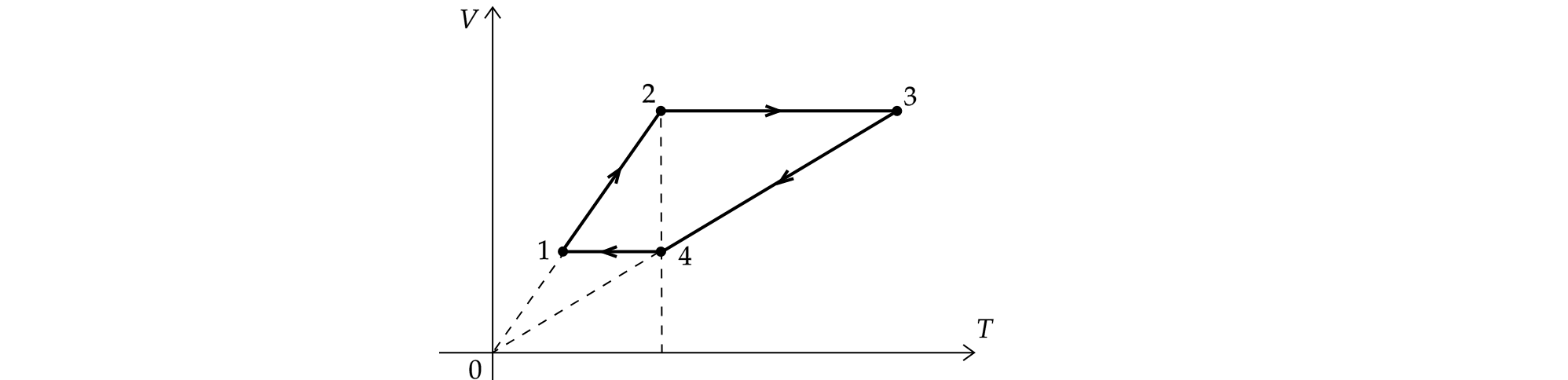
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Внешние силы в процессе 3-4 совершили над газом большую работу, чем совершил газ в процессе 1-2.
2) Газ за цикл совершает положительную работу.
3) Внутренние энергии газа в состоянии 2 и в состоянии 4 равны.
4) В процссе 4-1 газу было передано положительное количество теплоты.
5) Давление газа в состоянии 3 больше, чем в состоянии 4.
Для более удобной работы перестроим график из координат в координаты
:
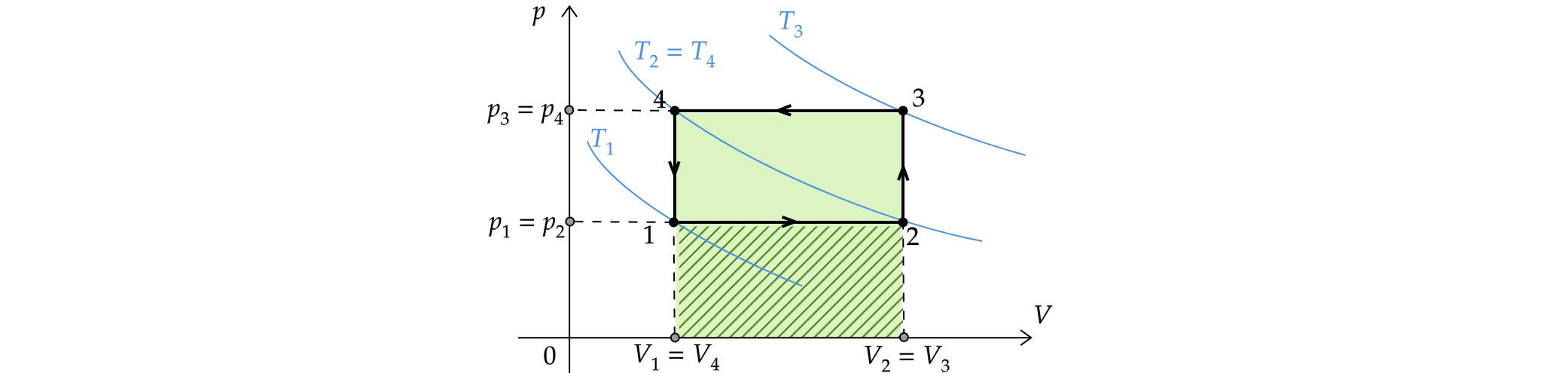
1)
Работу газа и работу внешних сил можно найти как площади фигур под графиками этих процессов. По рисунку видно, что площадь
под графиком процесса 3-4 больше, чем под графиком процесса 1-2. Значит, работа внешних сил в процессе 3-4 больше, чем работа
газа в процессе 1-2.
2)
Работа , совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1 (только в
-координатах!!!).
Так как объем газа остался неизменным, а его давление уменьшилось, то газ совершил за цикл отрицательную
работу.
3)
Внутренняя энергия газа зависит от его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
По графику в -координатах видно, что
. Следовательно, внутренние энергии в состоянии 2 и в состоянии 4
равны.
4)
Процесс 4-1 является изохорным (так как ). Запишем первый закон термодинамики для изохорного процесса:
Изменение внутренней энергии газа зависит от изменения его температуры:
По графику видно, что изотерма лежит ниже, чем изотерма
. Следовательно, температура газа уменьшается:
. Значит, изменение внутренней энергии газа
отрицательно. То есть газ не получает теплоту, а отдает
ее.
5)
По графику в -координатах видно, что точка 3 и точка 4 лежат на одной изобаре. Следовательно, давление газа в этих
состояниях одинаково.
Ошибка.
Попробуйте повторить позже
На -диаграмме изображен процесс перехода одноатомного идеального газа из состояния 1 в состояние 4. Количество вещества
газа постоянно.
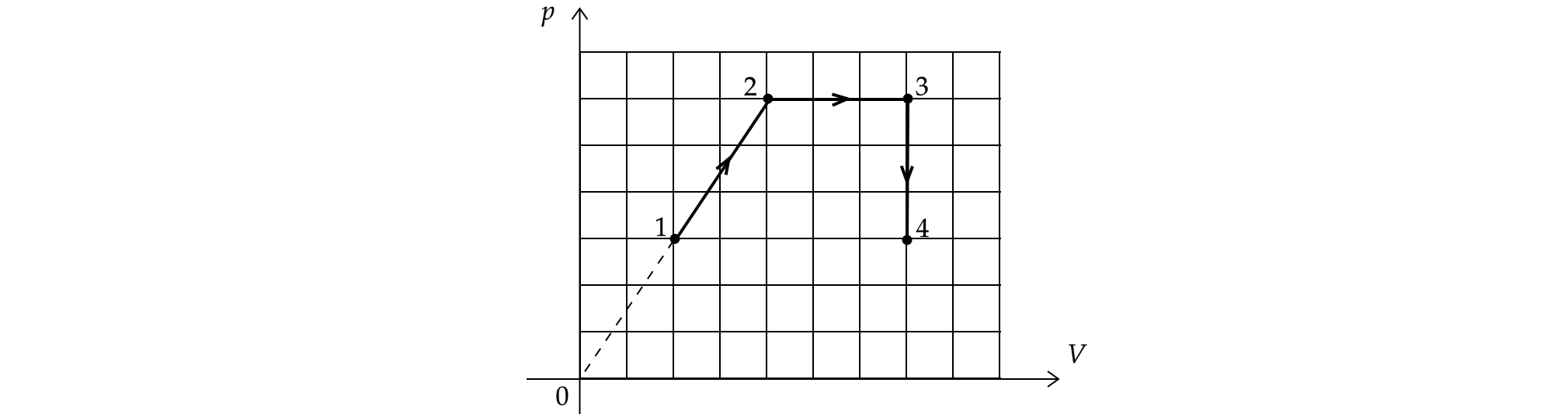
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Внутренняя энергия газа в состоянии 2 минимальна.
2) В процессе 3-4 газ получает положительное количество теплоты.
3) Температура газа в состоянии 2 и в состоянии 4 одинакова.
4) Работа, совершенная газом в процессе 2-3, в 2 раза больше работы, совершенной в процессе 1-2.
5) В процессе 3-4 работа внешних сил над газом равна нулю.
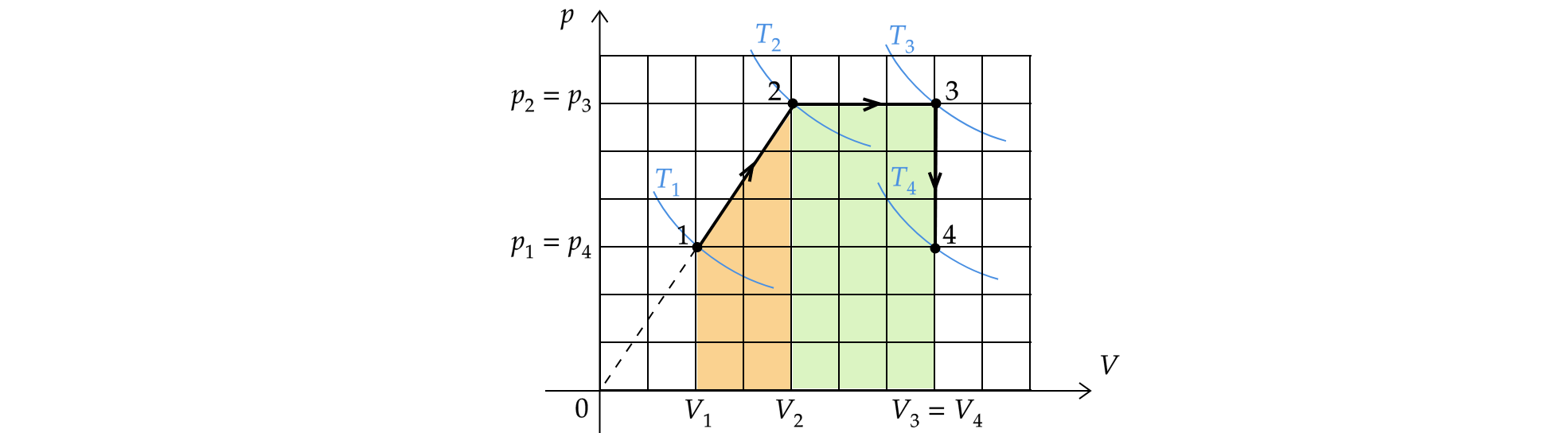
1)
Внутренняя энергия газа зависит от его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
Мысленно проведем изотермы ,
,
и
. Изотерма
лежит ”выше” изотермы
. Следовательно, температура газа в
состоянии 2 не минимальна:
2)
Процесс 3-4 является изохорным (так как ). Запишем первый закон термодинамики для изохорного процесса:
По рисунку видно, что изотерма лежит ”ниже” изотермы
. Следовательно, температура газа уменьшается:
. Значит, изменение внутренней энергии
отрицательно, и газ не получает положительное количество
теплоты, а отдает его.
3)
Пусть деление клетки по горизонтали , а по вертикали
.
Исходя из обобщенного газового закона, найдем, как соотносится температура с температурой
:
4)
Работу газа можно вычислить как площадь под графиком процесса (процесс 2-3 — как площадь прямоугольника, процесс 1-2 — как
площадь трапеции).
Найдем отношение этих работ: 5)
По графику видно, что объем газа в процессе 3-4 постоянен. Следовательно, работа газа равна нулю. Следовательно, и работа
внешних сил равна нулю:
Ошибка.
Попробуйте повторить позже
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах , где
—
давление газа,
— объем газа. Количество вещества газа остается неизменным.
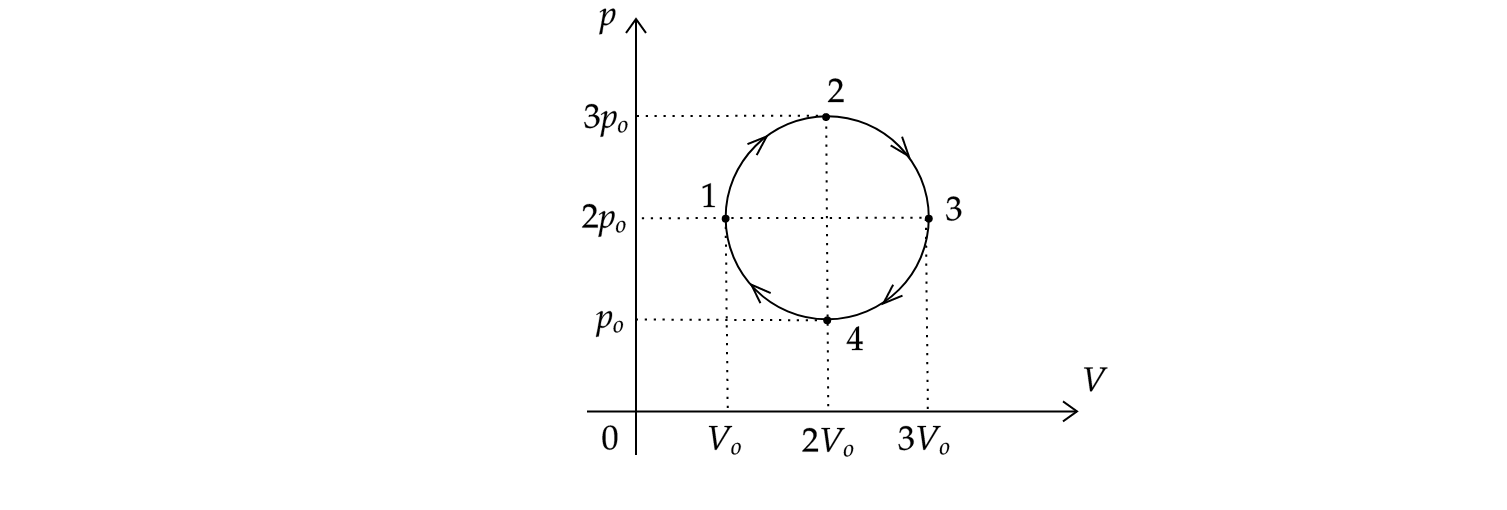
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Внутренняя энергия газа в состоянии 3 больше, чем в состоянии 1.
2) В процессе 1-2 газ отдал положительное количество теплоты в окружающую среду.
3) Внешние силы в процессе 4-1 совершили большую работу, чем совершил газ в процессе 2-3.
4) Газ за цикл совершил положительную работу.
5) В процессе 3-4 внутренняя энергия газа постоянна.
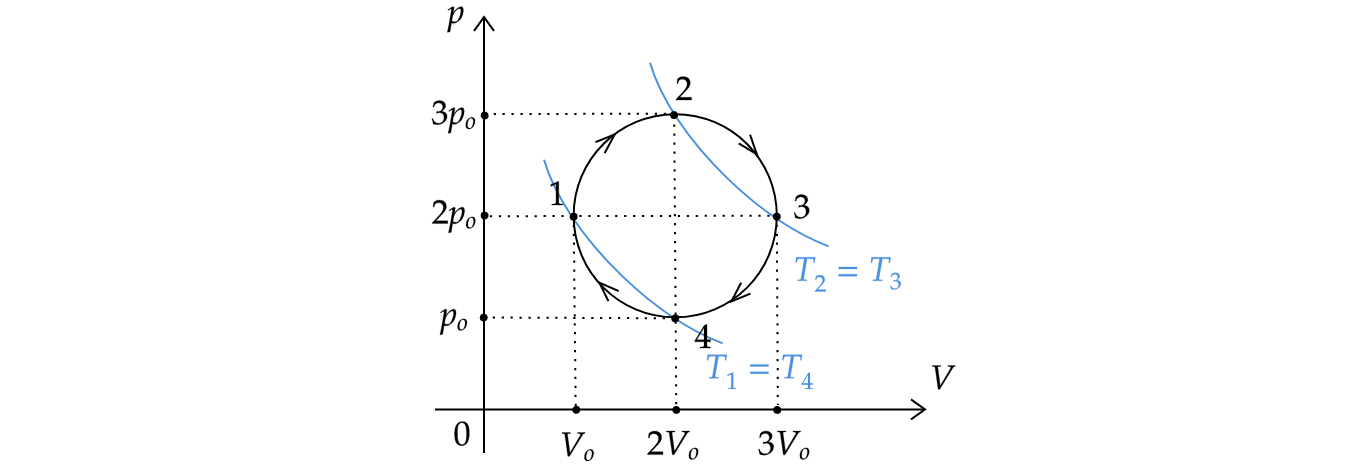
1)
Внутренняя энергия газа зависит от его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
Проведем две изотермы. По рисунку видно, что изотерма лежит ”выше”, чем изотерма
:
. Следовательно,
внутренняя энергия газа в состоянии 3 больше, чем в состоянии 1.
2)
Запишем первый закон термодинамики для процесса 1-2:
Работа газа зависит от изменения его объема:
По графику видно, что объем газа в процессе 1-2 увеличивается. Следовательно, газ совершил положительную работу.
Изменение внутренней энергии газа зависит от температуры:
Так как изотерма лежит ”выше” изотермы
, то
. Cледовательно, изменение температуры положительно:
. Следовательно, и изменение внутренней энергии
также положительно.
Так как изменение внутренней энергии газа и его работа положительны, то и количество теплоты также положительно.
Значит, газ не отдает тепло в окружающую среду, а получает его.
3)
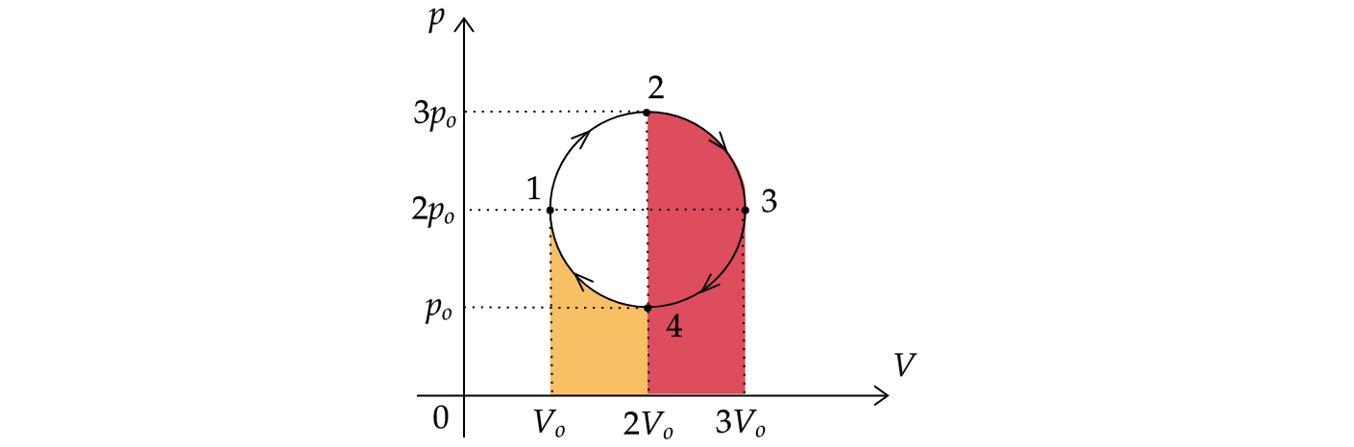
Работу газа и работу внешних сил можно найти как площади под графиком процессов 4-1 и 2-3. Видно, что площадь под графиком процесса 4-1 меньше, чем под графиком процесса 2-3. Следовательно, внешние силы в процессе 4-1 совершили меньшую работу, чем совершил газ в процессе 2-3.
4)
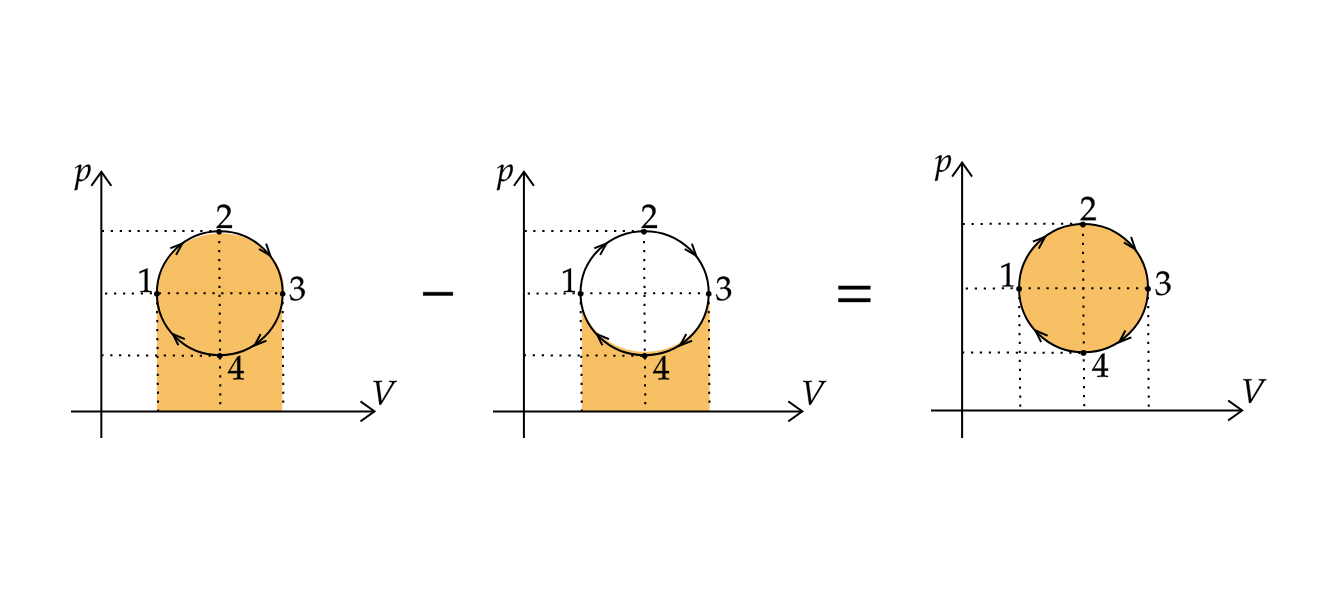
Работа , совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1.
Работа, совершенная газом в процессе 1-2-3, положительна и равна площади под графиком, а работа, совершенная в процессе 3-4-1,
отрицательна и также равна площади под графиком.
Суммарная работа равна разности этих двух площадей и, следовательно, равна площади внутри замкнутой кривой, изображающей
цикл. Так как объем газа увеличился, то его работа за цикл положительна.
5)
Изменение внутренней энергии газа зависит от изменения его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
По рисунку видно, что изотерма лежит ”ниже”, чем изотерма
:
. Следовательно, внутренняя энергия газа в
состоянии 4 меньше, чем в состоянии 3:
.
Ошибка.
Попробуйте повторить позже
На -диаграмме отображена последовательность четырех процессов изменения состояния 2 моль идеального одноатомного
газа.
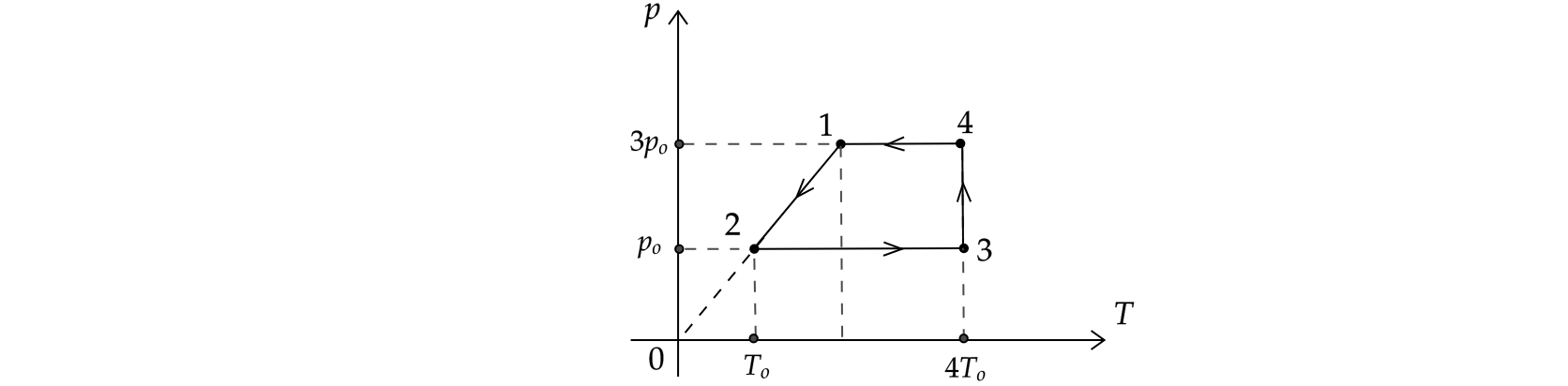
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Газ за цикл совершает отрицательную работу.
2) Работа газа в процессе 1-2 максимальна по модулю.
3) В процессе 2-3 газ отдает положительное количество теплоты в окружающую среду.
4) Изменение внутренней энергии газа в процессе 1-2 в три раза больше, чем в состоянии 4-1.
5) В состоянии 3 объем газа максимален.
Для более удобной работы перестроим график из координат в координаты
:
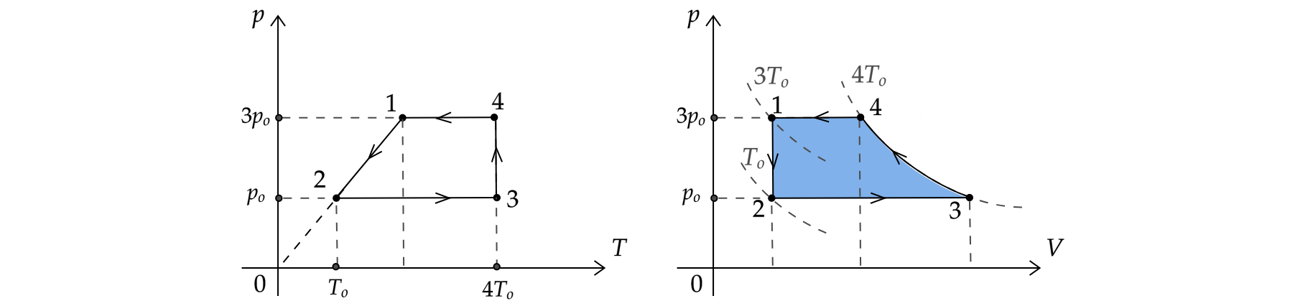
1)
Работа , совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1. Так как объем газа уменьшается
(направление цикла против часовой стрелки), то работа цикла отрицательна.
2)
Работа газа зависит от изменения объема:
По графику (в -координатах это очевидно, в
-координатах можно исходить из того, что точки 1 и 2
лежат на одной изохоре) видно, что в процессе 1-2 объем газа остается неизменным. Следовательно, газ не совершает
работу.
3)
Процесс 2-3 — изобарный (т.к. ). Запишем первый закон термодинамики для изобарного процесса:
Работа газа зависит от изменения объёма газа:
По рисунку видно, что . Cледовательно, изменение объема положительно:
. Значит, газ совершил
положительную работу.
Изменение внутренней энергии газа зависит от температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
Мысленно проведем две изотермы: и
. Так как изотерма
лежит ”выше” изотермы
, то
. Cледовательно,
изменение температуры положительно:
. Следовательно, и изменение внутренней энергии
также
положительно.
Так как изменение внутренней энергии газа и его работа положительны, то и количество теплоты также положительно,
поэтому газ не отдает теплоту, а получает ее.
4)
Найдем отношение изменений внутренних энергий и
.
Температуру можно найти из закона Гей-Люссака (т.к. процесс 1-2 изохорный):
Подставим это значение в предыдущую формулу:
5)
Исходя из графика в -координатах, очевидно, что утверждение верно.
На графике в -координатах можно провести изохоры и убедиться, что изохора
лежит ”ниже” всех остальных.
Следовательно, объем газа в состоянии 3 максимален.
Ошибка.
Попробуйте повторить позже
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах , где
—
давление газа,
— объем газа. Количество газа остается неизменным.
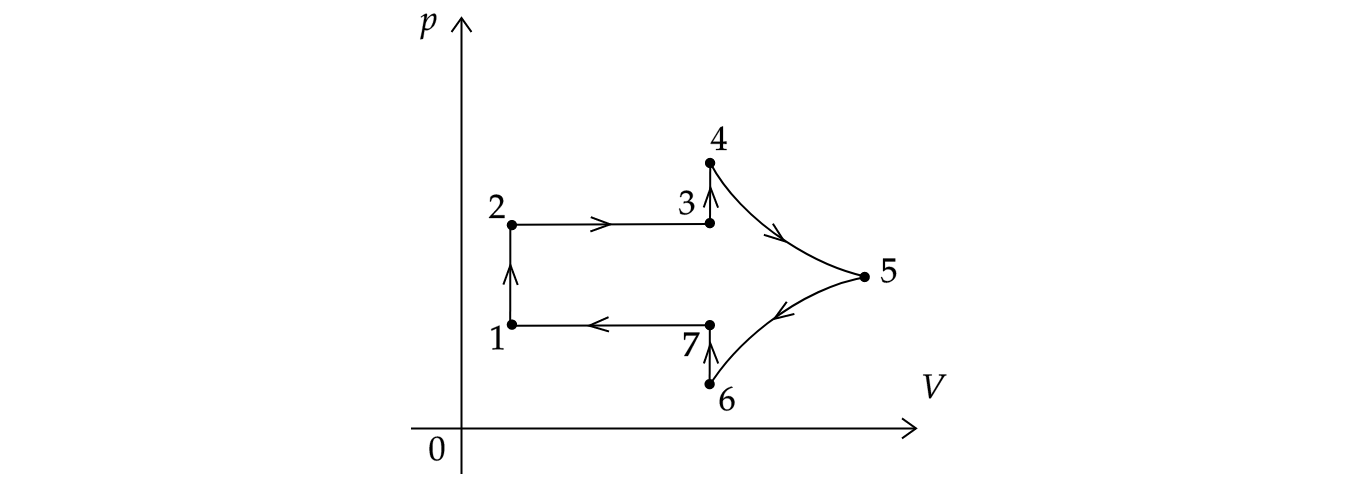
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Процесс 5-6 является изотермическим.
2) В процессе 2-3 газ совершает положительную работу, причем его внутренняя энергия увеличивается.
3) Работа газа за цикл равна нулю.
4) В процессе 6-7 газ получает положительное количество теплоты.
5) Работа газа в процессе 4-5 минимальна по модулю.
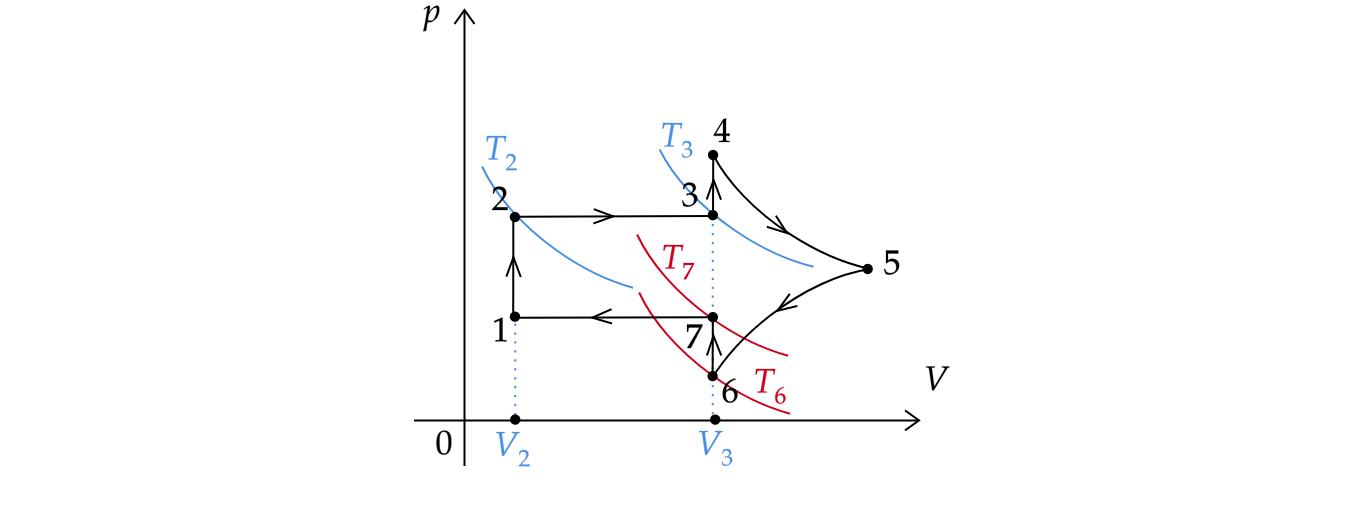
1)
Процесс 5-6 не является изотермическим.
2)
Работа газа прямо пропорциональна изменению его объема и в процессе 2-3 она равна:
Заметим, что . Следовательно, и изменение объема газа также больше нуля:
. Следовательно, газ в
процессе 2-3 совершает положительную работу:
.
Изменение внутренней энергии газа зависит от изменения его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
Процесс 2-3 является изобарным. Следовательно, температура газа изменяется. Мысленно проведем на графике две изотермы: и
. Так как изотерма
лежит ”выше” изотермы
, то
. Cледовательно, изменение температуры положительно:
. Следовательно, и изменение внутренней энергии
также положительно, поэтому внутренняя энергия газа в
процессе 2-3 увеличивается.
3)
Работа , совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-5-6-7-1. Так как объем газа
увеличивался (цикл направлен по часовой стрелке), то работа цикла положительна.
4)
Процесс 6-7 — изохорный (т.к. ). Запишем первый закон термодинамики для изохорного процесса:
Изменение внутренней энергии газа зависит от изменения его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
Мысленно проведем на графике две изотермы: и
. Так как изотерма
лежит ”ниже” изотермы
, то
.
Cледовательно, изменение температуры положительно:
. Следовательно, и изменение внутренней энергии
также положительно.
Так как изменение внутренней энергии газа положительно, то и количество теплоты также положительно. Значит, газ
получает положительное количество теплоты.
5)
Работу газа в процессе 4-5 можно найти как площадь под графиком этого процесса. По рисунку видно, что площадь под под
графиком 4-5 не самая наименьшая (сравните ее с площадью под графиком процесса 5-6). Следовательно, и модуль работы газа,
совершенной за этот процесс, не минимален.
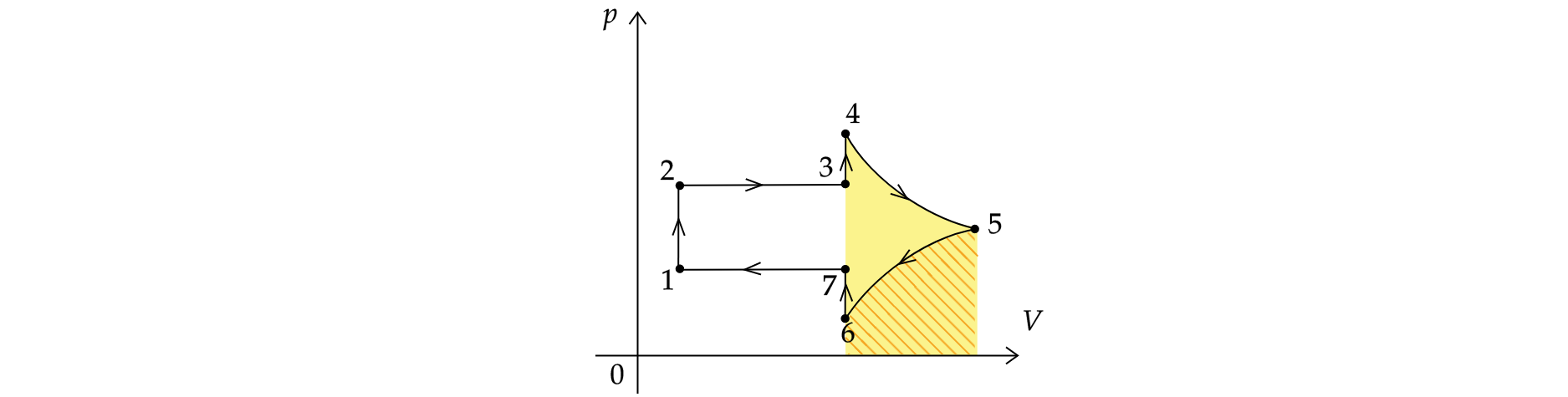
Ошибка.
Попробуйте повторить позже
На рисунке показан график циклического процесса, проведенного с одноатомным идеальным газом, в координатах , где
—
давление газа,
— объем газа. Количество вещества газа остается неизменным.
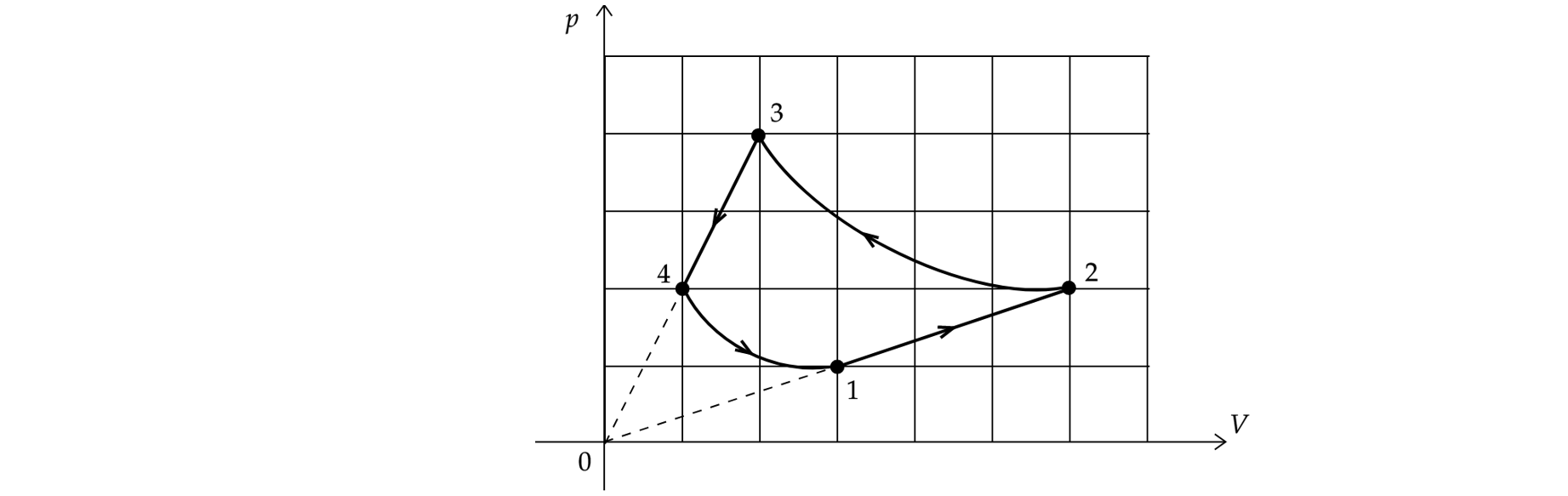
Из приведенного ниже списка выберите все правильные утверждения, характеризующих процессы на графике.
1) Процесс 2-3 является изотермическим.
2) Работа, совершенная над газом в процессе 3-4, в 1,5 раза меньше, чем работа, совершенная газом в процессе 1-2.
3) В процессе 1-2 внутренняя энергия газа увеличивалась.
4) Газ за цикл совершил положительную работу.
5) В процессах 1-2 и 3-4 количество теплоты, переданной системе, равно нулю.
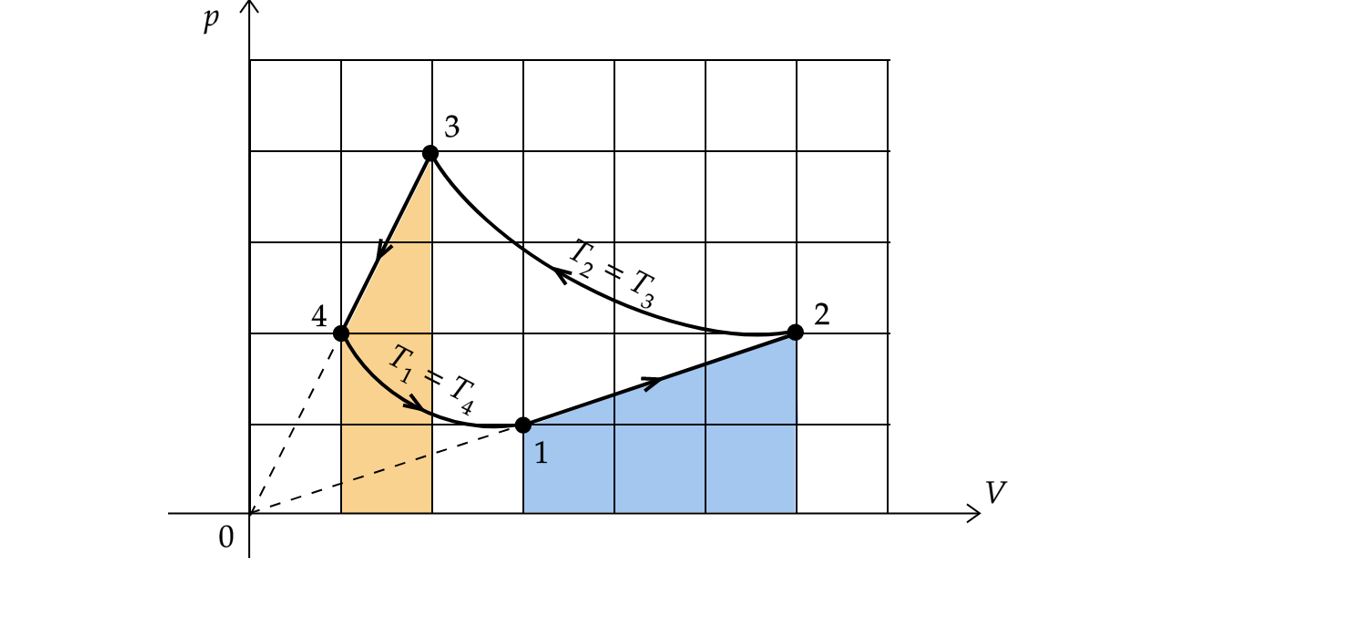
1)
Из закона Менделеева-Клапейрона для постоянного количества газа:
где – температура,
– количество вещества,
– универсальная газовая постоянная.
Справа постоянная величина, следовательно, слева тоже постоянно.
Тогда
Так как , а
, то
. То есть процесс не изотермический.
2)
Пусть деление клетки по горизонтали , а по вертикали –
.
Работу газа можно найти как площадь под графиком процесса (процессы 1-2 и 3-4 – как площадь трапеции).
Найдем отношение этих работ:
3)
Изменение внутренней энергии газа зависит от изменения его температуры:
где — количество вещества газа,
— универсальная газовая постоянная.
По графику видно, что изотерма лежит ”выше”, чем изотерма
:
. Следовательно, изменение внутренней
энергии в процессе 1-2 положительно - она увеличилась.
4)
Работа , совершенная газом за цикл, равна площади, заключенной внутри кривой 1-2-3-4-1. Так как объем газа уменьшается
(направление цикла против часовой стрелки), то работа цикла отрицательна.
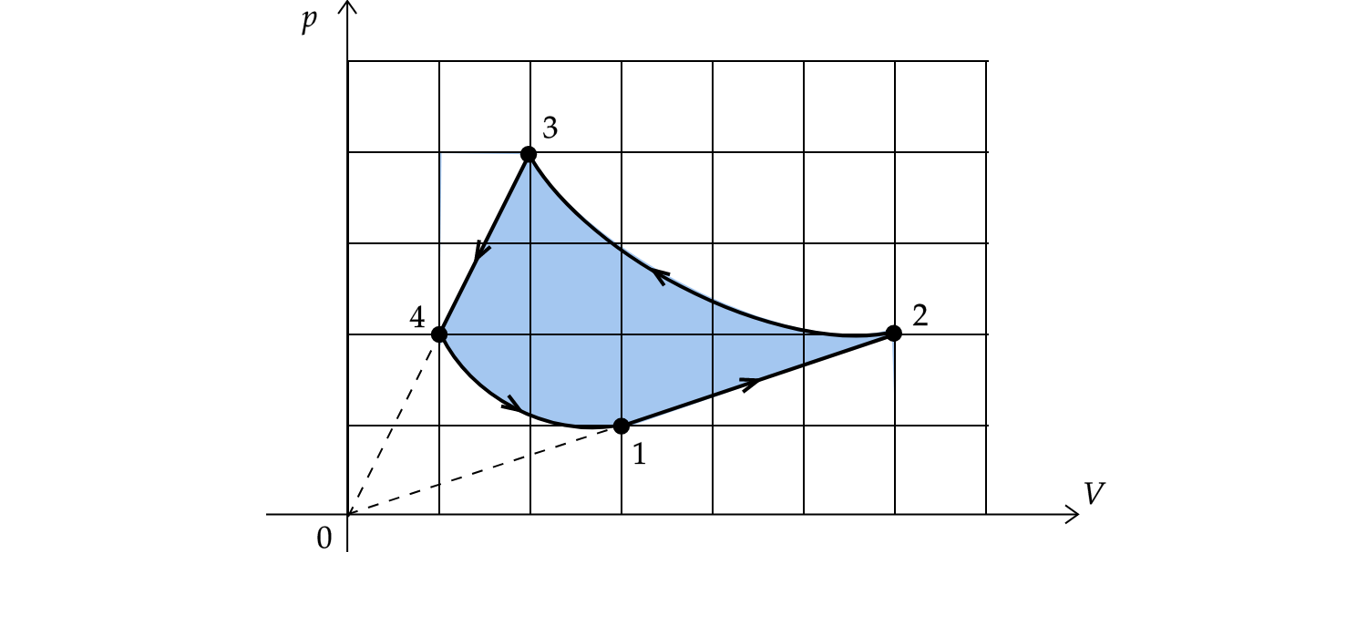
5)
Процессы 1-2 и 3-4 не являются адиабатными. Следовательно, количество теплоты, переданной системе, в этих процессах не равно
нулю.



