Ошибка.
Попробуйте повторить позже
В цилиндр с подвижным поршнем накачали моля идеального одноатомного газа при температуре
. Накачивание
вели так, что давление газа было постоянным. Затем накачку прекратили и дали газу в цилиндре расшириться без теплообмена с
окружающей средой до давления
атм. При этом газ остыл до температуры
. Какую суммарную работу совершил
газ в этих двух процессах? В исходном состоянии цилиндр был пуст и поршень касался дна. (Ответ дайте в кДж округлите до
целых.)
В первом процессе газ расширяется при постоянном давлении от объема 0 до . Так как
, то процесс изобарный и
работу газа, совершенную за этот процесс можно найти по формуле:
Запишем уравнение Менделеева – Клапейрона:
где — количество вещества газа,
— универсальная газовая постоянная,
.
Подставим (2) в (1):
Рассмотрим второй процесс. В условии сказано, что газ расширялся без теплообмена с окружающей средой, то есть второй
процесс был адиабатическим.
Запишем первое начало термодинамики для адиабатического процесса (с учетом того, что ):
где — количество теплоты,
— изменение внутренней энергии газа. Выразим работу газа, совершенную во втором
процессе:
Изменение внутренней энергии одноатомного газа во втором процессе равно:
где изменение абсолютной температуры газа во втором процессе , причем
.
Подставим (4) в (3):
Найдем суммарную работу, которую совершил газ в этих двух процессах:
Ошибка.
Попробуйте повторить позже
При сжатии идеального одноатомного газа при постоянном давлении внешние силы совершили работу 800 Дж. Чему равно изменение внутренней энергии газа? Ответ укажите в Дж.
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа. Запишем уравнение
Менделеева-Клапейрона:
где – объём,
– количество вещества.
Изменение внутренней энергии
Работа газа в изобарном процессе
Тогда
При этом работа над газом равна . Тогда
Ошибка.
Попробуйте повторить позже
На рисунке показан циклический процесс изменения состояния постоянной массы одноатомного идеального газа (V – объём газа, T – его абсолютная температура). На каком из участков процесса (1, 2, 3 или 4) работа газа положительна и равна полученному газом количеству теплоты?
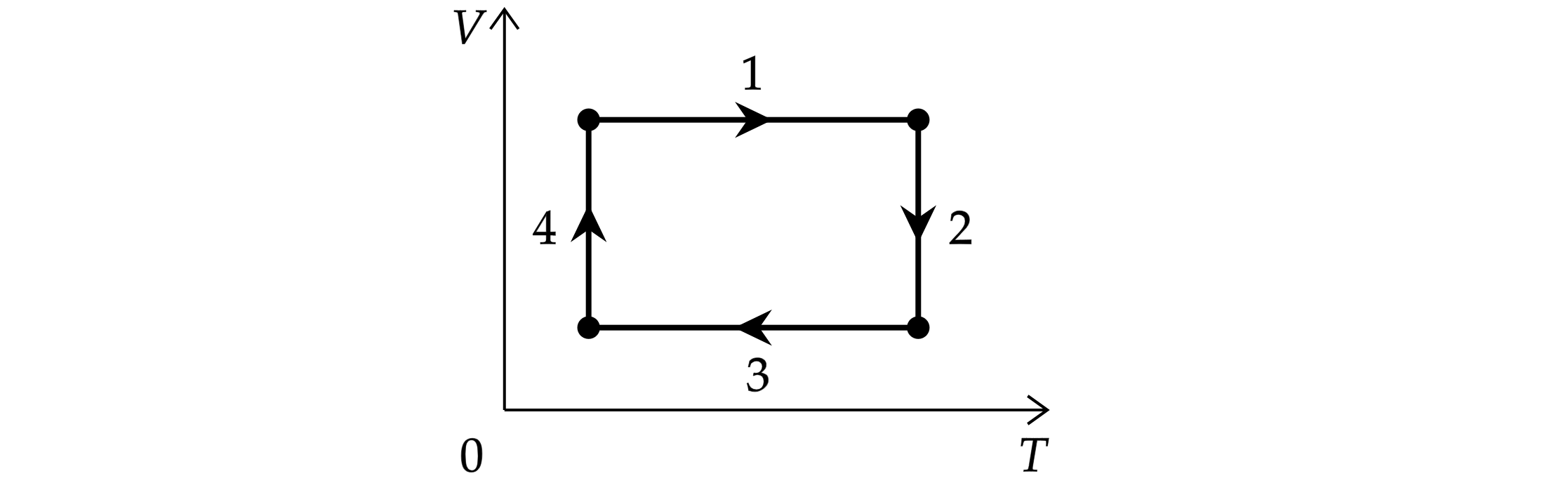
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Работа газа положительна при увеличении объёма (только процесс 4).
Ошибка.
Попробуйте повторить позже
В процессе эксперимента внутренняя энергия газа уменьшилась на 20 кДж, при этом в процессе расширения он совершил работу 12 кДж. Какое количество теплоты газ отдал окружающей среде? Ответ дайте в кДж.
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
В данном случае
то есть газ отдал 8 кДж энергии.
Ошибка.
Попробуйте повторить позже
Газ получил количество теплоты, равное 300 Дж, при этом внутренняя энергия газа уменьшилась на 100 Дж. Масса газа не менялась. Какую работу совершил газ в этом процессе? Ответ дайте в Дж.
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Тогда газ совершил в этом процессе работу, равную:
Ошибка.
Попробуйте повторить позже
На рисунке показан график изменения состояния постоянной массы одноатомного идеального газа. В этом процессе газ получил количество теплоты, равное 3 кДж. Насколько в результате этого увеличилась его внутренняя энергия? Ответ дайте в кДж.
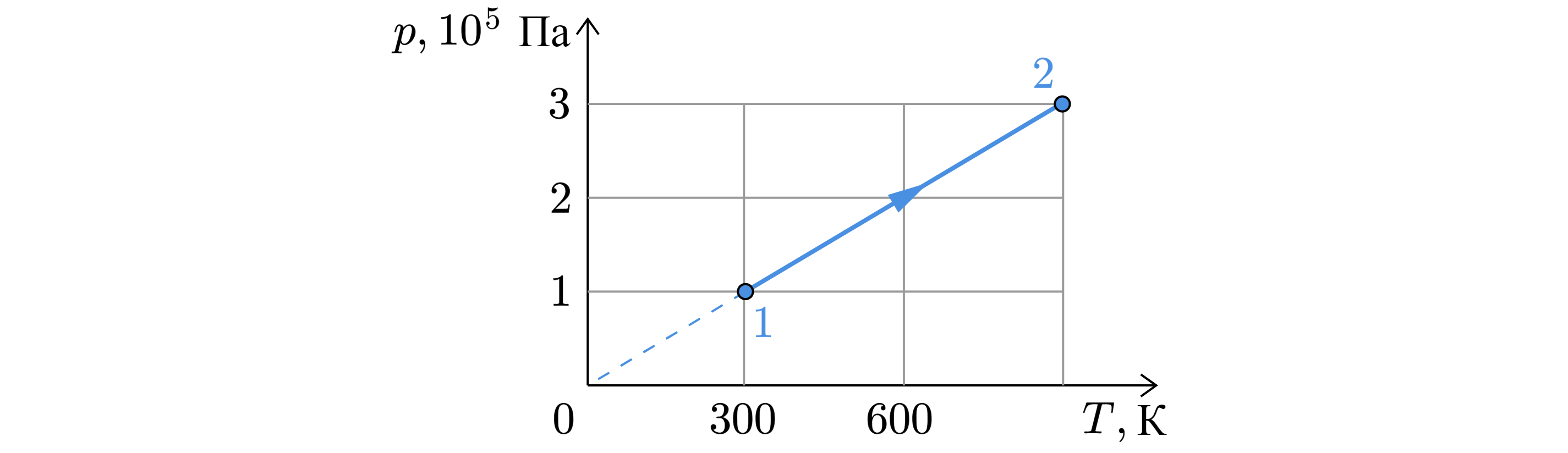
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Из графика:
где – некоторый коэффициент.
Запишем уравнение Менделеева-Клапейрона:
где – объём,
– количество вещества.
Отсюда объём
то есть объём постоянен, значит, работа газа равна нулю и
Ошибка.
Попробуйте повторить позже
Газ получил извне количество теплоты, равное 200 Дж, и при этом внешние силы совершили над ним работу, равную 80 Дж. Масса газа не менялась. На сколько увеличилась внутренняя энергия газа? Ответ дайте в Дж.
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
В данном случае работа совершается над газом, значит, работа газа отрицательна.
Выразим изменение внутренней энергии:
Ошибка.
Попробуйте повторить позже
На Tp-диаграмме показан процесс изменения состояния идеального одноатомного газа. Масса газа в ходе процесса не меняется. Внутренняя энергия газа уменьшилась на 30 кДж. Определите количество теплоты, отданное газом. Ответ дайте в кДж.
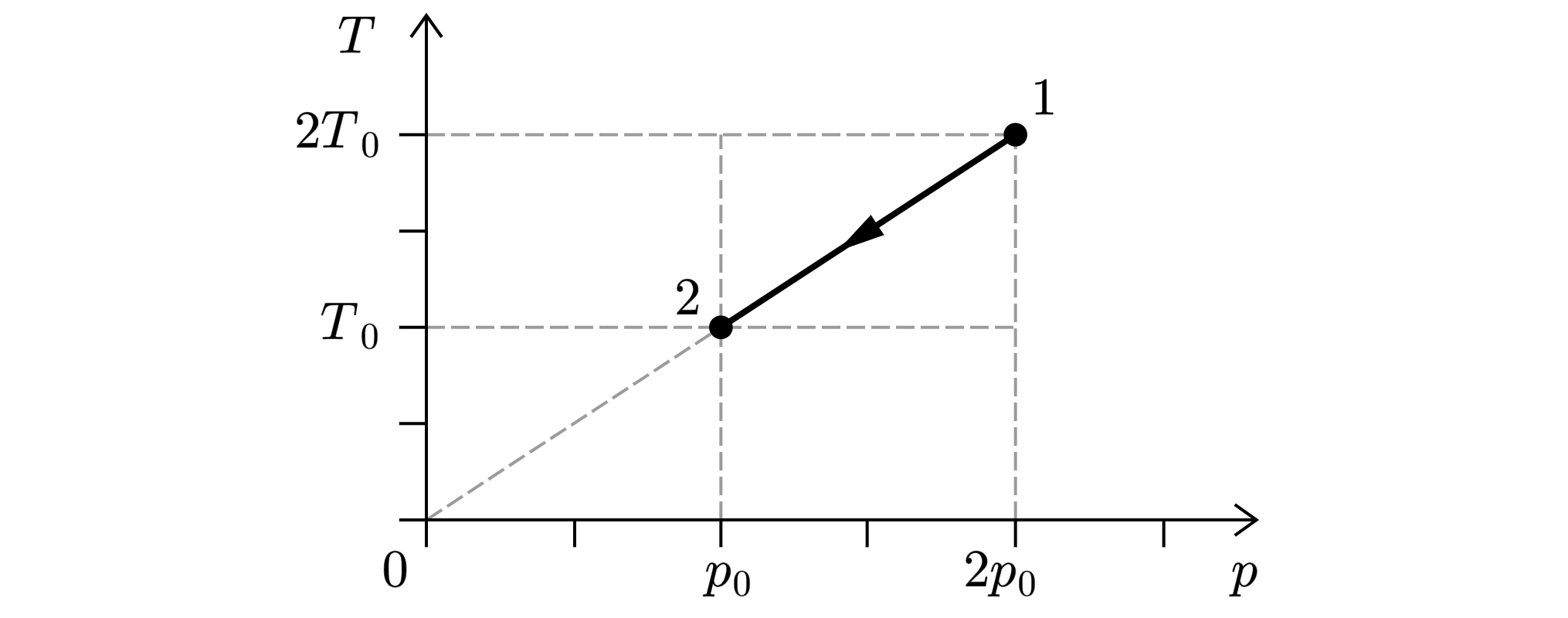
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа. Запишем уравнение
Менделеева-Клапейрона:
где – объём,
– количество вещества.
Так как по условию:
где – некоторый коэффициент.
То
То есть объём газа постоянен и работа газа не совершается.
Тогда
Ошибка.
Попробуйте повторить позже
Газ получил количество теплоты, равное 300 Дж, при этом внутренняя энергия газа уменьшилась на 100
Дж. Масса газа не менялась. Какую работу совершил газ в этом процессе? (Ответ дайте в джоулях.)
Демоверсия 2023
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа. Выразим работу
газа:
Ошибка.
Попробуйте повторить позже
На рисунке показан циклический процесс изменения состояния 1 моль одноатомного идеального газа. На
каком участке цикла изменение внутренней энергии газа равно полученному газом количеству теплоты?
Демоверсия, 2022
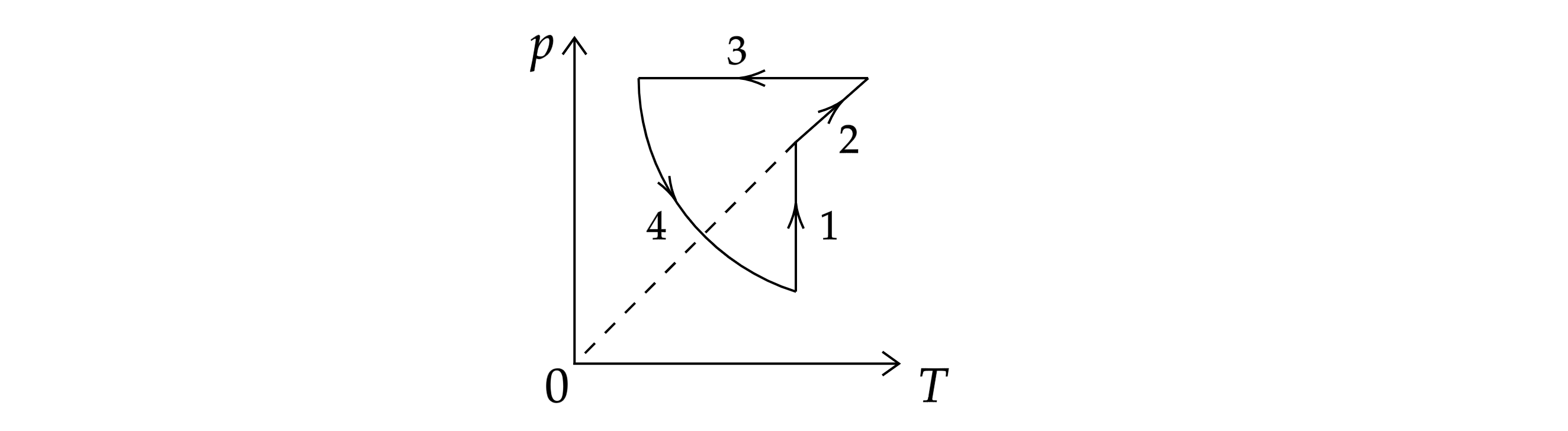
Первое начало термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа,
— работа газа.
То есть работа газа должна быть равна нулю, значит, объём постоянен. По уравнению Клапейрона-Менделеева:
где – объём газа.
При постоянном давлении имеем:
то есть прямая линия под некоторым наклоном (2)
Ошибка.
Попробуйте повторить позже
На рисунке показан циклический процесс изменения состояния постоянной массы одноатомного идеального газа. На каком участке работа газа положительна и равна полученному газом количеству теплоты
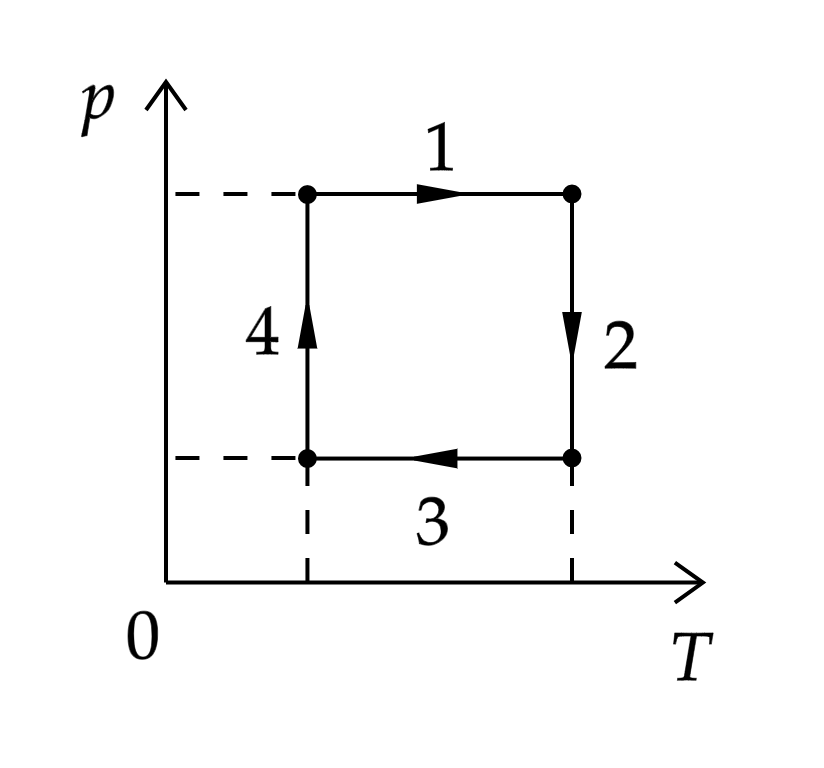
По первому началу термодинамики:
где – количество теплоты, полученное газом,
– изменение внутренней энергии,
– работа газа.
Так как , то
, при этом изменение внутренней энергии равно:
где – количество вещества,
– изменение температуры.
Следовательно, температура не изменялась.
Работа газа положительна, если объём газа увеличивается. По закону Бойля-Мариотта:
где – объём, то есть объём увеличивается при уменьшении давления, что соответствует графику 2.
Ошибка.
Попробуйте повторить позже
Внутреннюю энергию 2 молей одноатомного идеального газа уменьшили на 800 Дж, а внешние силы совершили над ним работу 400 Дж. Какое количество теплоты отдал газ? Ответ дайте в Джоулях.
Запишем первый закон термодинамики
где – изменение внутренней энергии,
– работа внешних сил.
Ошибка.
Попробуйте повторить позже
Внутренняя энергия газа в процессе эксперимента увеличилась на 33 кДж, при этом внешние силы совершили работу над газом, равную 51 кДж. Какое количество теплоты газ отдал окружающей среде? Ответ выразить в кДж.
По первому закону термодинамики:
где — количество теплоты,
— изменение внутренней энергии газа, а
— работа, совершенная газом.
где — работа внешних сил над газом.
Отсюда:
Значит, газ отдал окружающей среде количество теплоты, равное 18 кДж.
Ошибка.
Попробуйте повторить позже
Некоторое количество идеального одноатомного газа нагреваются в плотно закрытом сосуде. Зная, что масса газа г и газ
получил количество теплоты
Дж. Определите, на сколько повысилась температура газа, если молярная масса газа равна
кг/моль. Ответ дайте в Кельвинах и и округлите до целых.
По первому закону термодинамики:
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
— работа,
совершенная газом.
, т.к. по условию
(сосуд плотно закрыт).
Отсюда:
Осталось выразить :
Ошибка.
Попробуйте повторить позже
В некотором процессе идеальный газ совершает работу 140 Дж, причем полученное газом количество теплоты составляет 16/7 от изменения внутренней энергии газа (внутренняя энергия увеличивается). Чему равно изменение внутренней энергии газа в этом процессе? Ответ дайте в Дж и округлите до целых.
По первому закону термодинамики:
| Q = ΔU + A, |
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
—
работа, совершенная газом.
По условию . Отсюда:
|
|
|
A = |
Ошибка.
Попробуйте повторить позже
В процессе адиабатного расширения четырех молей идеального одноатомного газа газ совершил работу 100 Дж. Определите изменение внутренней энергии газа в этом процессе. Ответ дайте в Дж.
По первому закону термодинамики:
В адиабатном процессе газ не получает теплоты от внешней среды:
Ошибка.
Попробуйте повторить позже
В некотором процессе газ получает количество теплоты 97 Дж, внутренняя энергия газа увеличивается, причём изменение его внутренней энергии составляет 4/7 от работы газа. Какую работу совершает газ в этом процессе? Ответ дать в Дж и округлить до целых.
По первому закону термодинамики:
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
— работа, совершенная газом.
По условию . Отсюда:
Ошибка.
Попробуйте повторить позже
На рисунке показан график изменения состояния постоянной массы идеального газа. В этом процессе газ отдал количество теплоты, равное 4 кДж. На сколько уменьшилась внутренняя энергия газа? Ответ дайте в кДж.
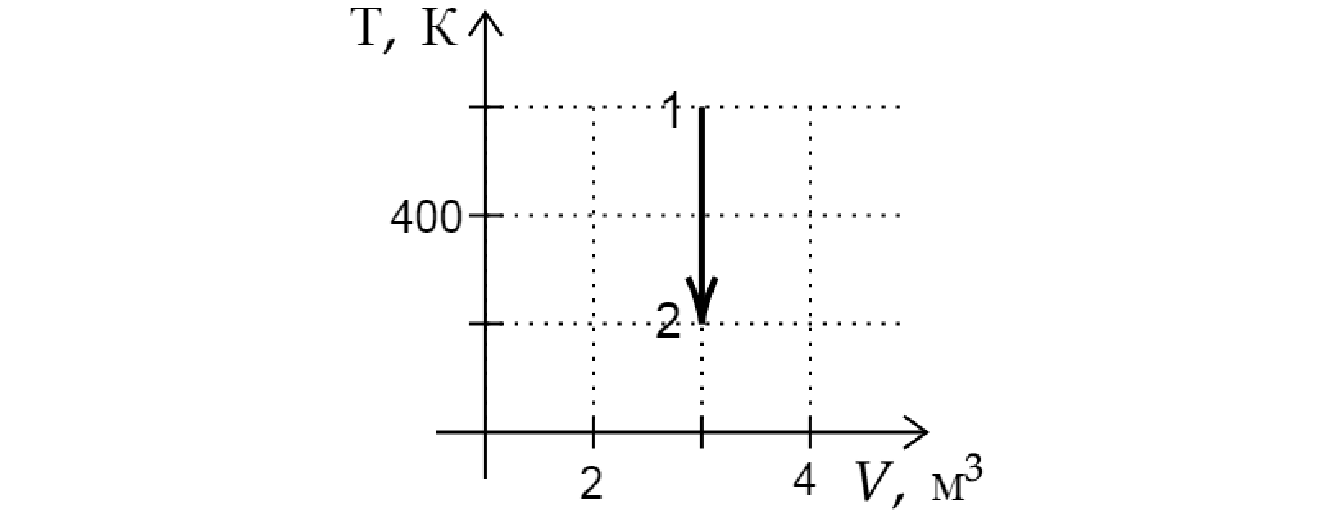
Из графика видно, что данный процесс является изохорным. Поскольку объем газа не изменялся, газ не совершал работы. Следовательно, согласно первому началу термодинамики:
Ошибка.
Попробуйте повторить позже
Идеальный газ совершил работу 161 кДж и при этом внутренняя энергия газа уменьшилась на 140 кДж. Какое количество теплоты получил газ в этом процессе? (Ответ дать в кДж)
По первому закону термодинамики:
где — количество теплоты, полученное газом,
— изменение внутренней энергии газа, а
— работа, совершенная
газом.
Ошибка.
Попробуйте повторить позже
В процессе адиабатного сжатия над 2 молями идеального одноатомного газа совершают работу 980,5 Дж. Определите модуль изменения температуры данной порции газа в результате этого процесса. Ответ дайте в К и округлите до целых.
По первому закону термодинамики:
В адиабатном процессе газ не получает теплоты от внешней среды:
Отсюда:



