Ошибка.
Попробуйте повторить позже
На рисунке представлен график зависимости объёма идеального газа от его температуры в некотором процессе. В состоянии 1 давление газа было равно нормальному атмосферному давлению. Какое давление соответствует состоянию 2, если масса газа остаётся неизменной? Ответ дайте в кПа.
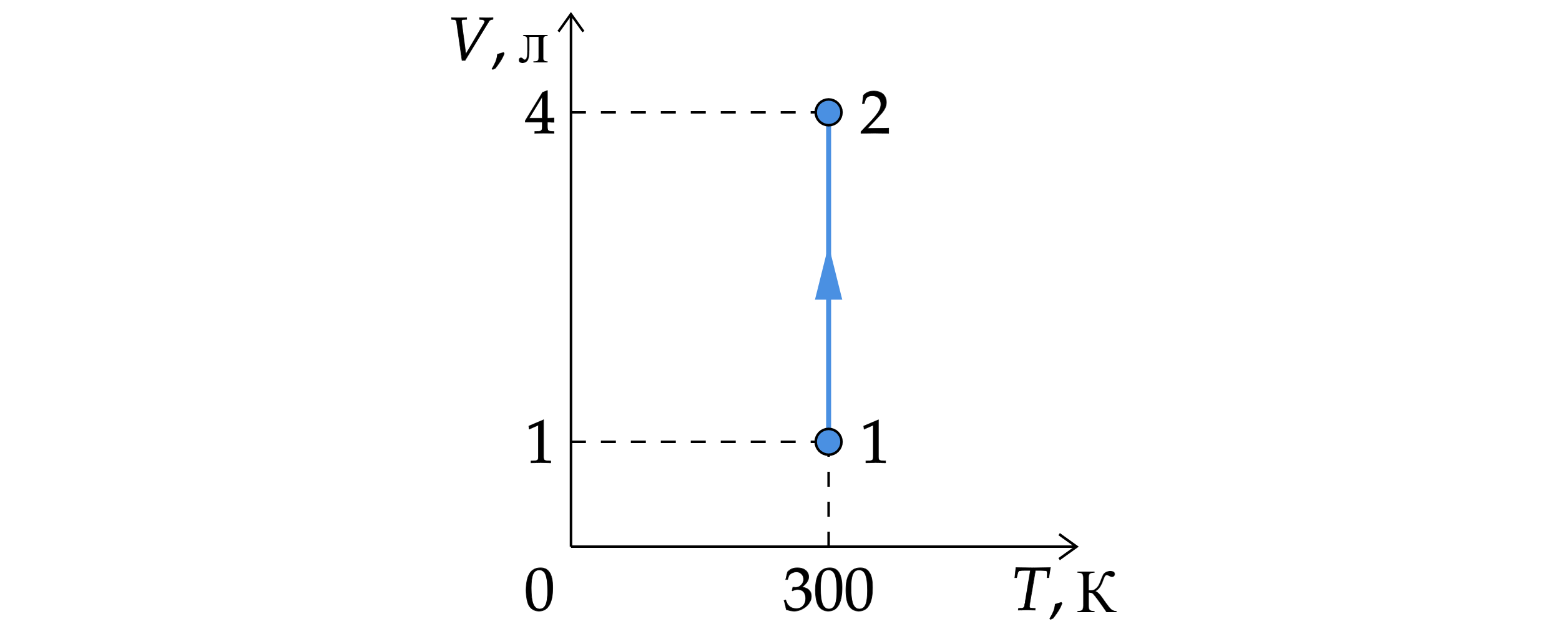
По закону Бойля – Мариотта:
тогда искомое давление
Ошибка.
Попробуйте повторить позже
С идеальным газом происходит изохорный процесс, в котором в результате увеличения абсолютной температуры газа в 2 раза его давление возросло на 75 кПа. Масса газа постоянна. Каково было первоначальное давление газа? Ответ дайте в кПа.
Запишем уравнение Менделеева-Клапейрона:
где — давление газа,
— объём,
— количество вещества,
— универсальная газовая постоянная,
— абсолютная
температура.
Так как процесс изохорный, то . Отсюда отношение температур:
по условию и
, тогда
Ошибка.
Попробуйте повторить позже
На рисунке показано изменение состояния идеального газа в количестве 0,5 моль. Какая температура соответствует состоянию 1? Ответ дайте в Кельвинах.
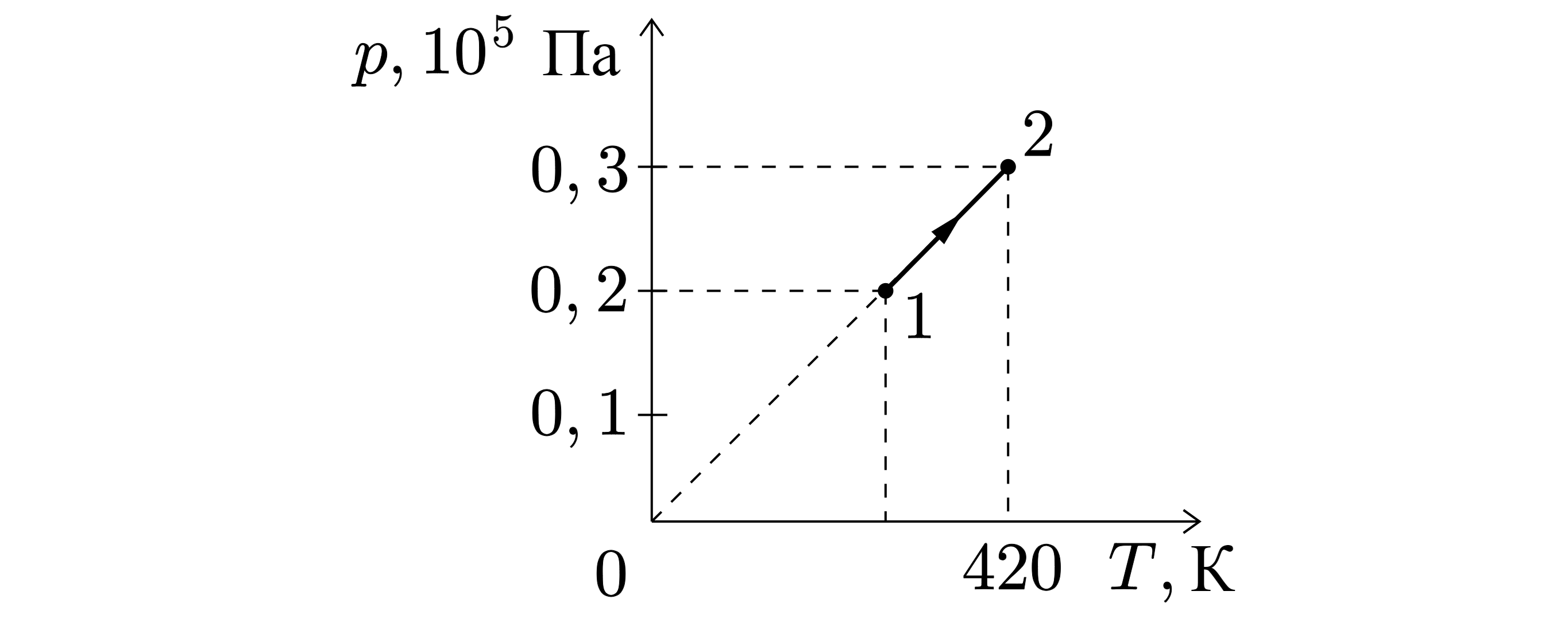
Для процесса 1-2 можно записать:
Тогда
Ошибка.
Попробуйте повторить позже
Идеальный газ находится в цилиндре под поршнем, при этом давление газа составляет 180 кПа. После того, как поршень подняли вверх, объём газа увеличился в 2,4 раза. Найдите давление газа после поднятия поршня. Температура газа не меняется. Ответ дайте в кПа.
Так как процесс изотермический , воспользуемся законом Бойля – Мариотта:
С учетом того, что по условию , найдем давление газа после поднятия поршня:
Ошибка.
Попробуйте повторить позже
На рисунке изображён график изменения состояния идеального газа в количестве 9 моль. Какое давление соответствует состоянию 1? Ответ дайте в кПа.
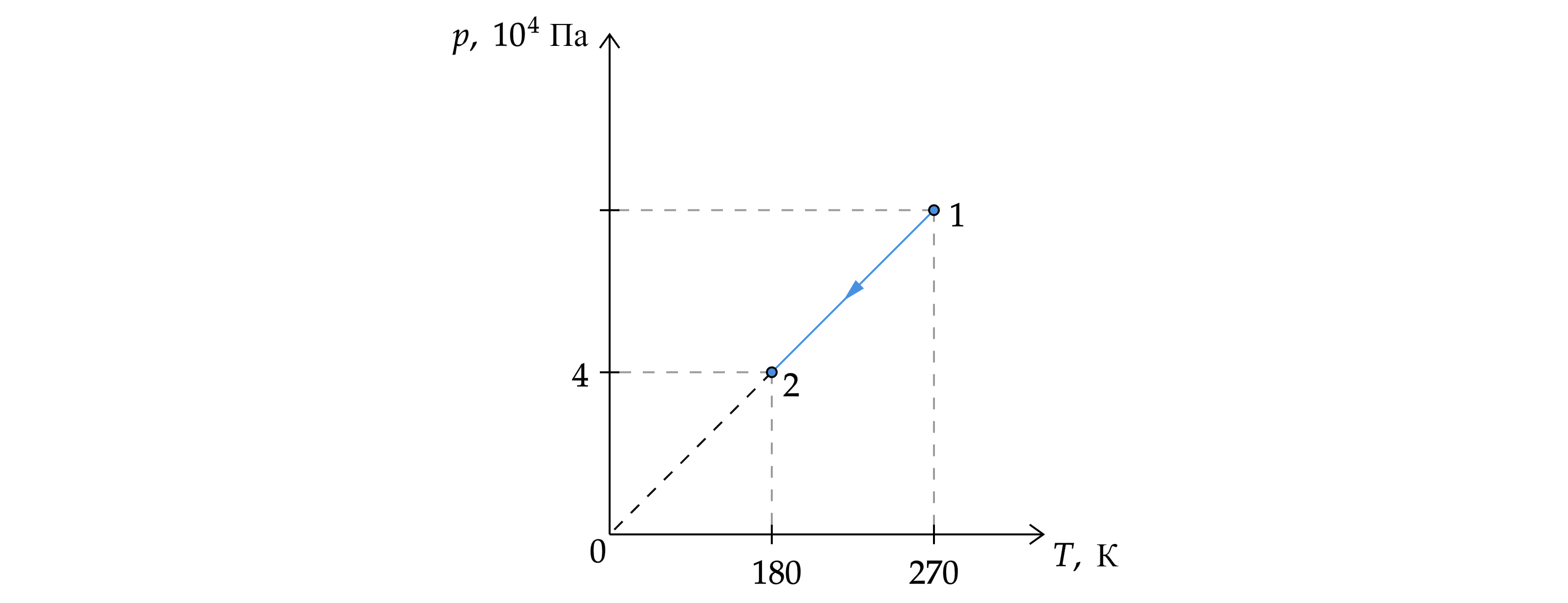
Так как прямая 1–2 в осях проходит через начало координат, то на рисунке изображена изохора
. По закону
Шарля:
Ошибка.
Попробуйте повторить позже
На рисунке представлен график зависимости давления от температуры газа. Объём газа в состоянии 2 равен 6 л. Какой объём
занимает газ в состоянии 1? Масса газа не меняется. Ответ дайте в .
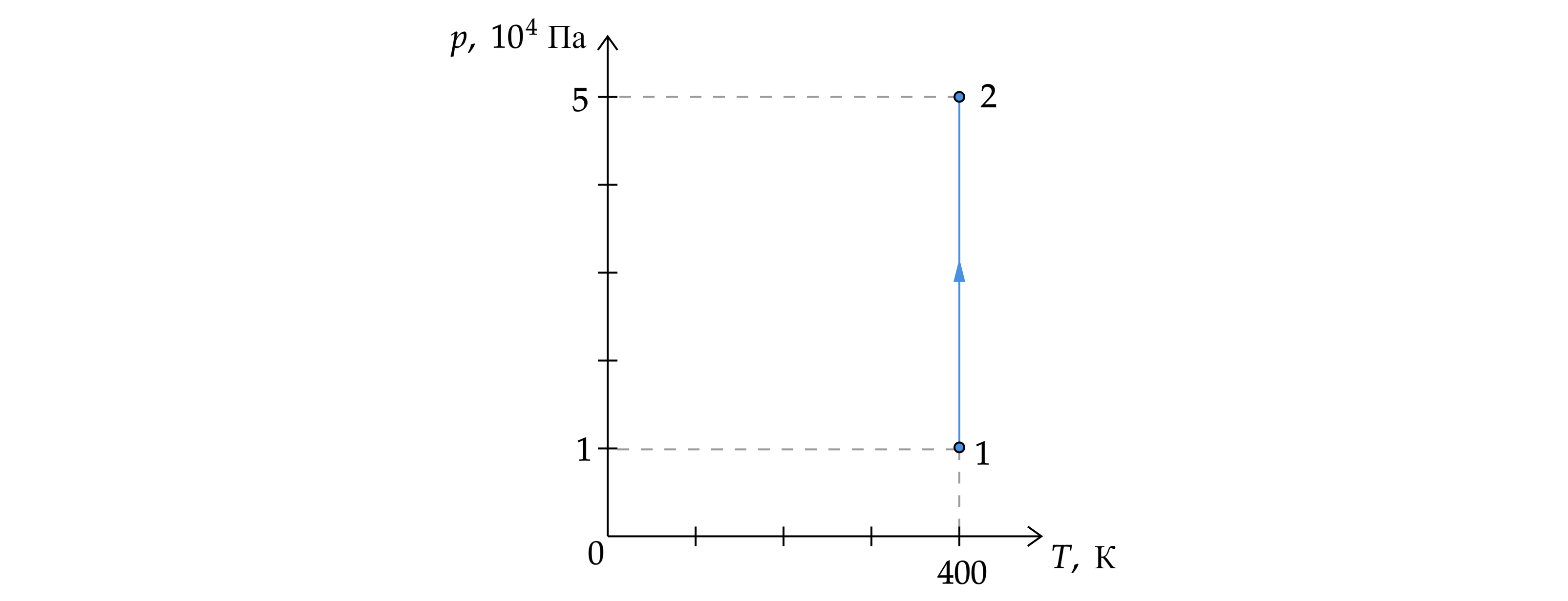
По графику видно, что процесс 1–2 — изотермический (). По закону Бойля – Мариотта:
Переведём объём газа в :
.
Ошибка.
Попробуйте повторить позже
Газ занимает объём 0,03 при температуре 418 К. Какой объём займёт этот же газ, если его температура понизится до 209 К?
Давление и масса газа не меняются. Ответ дайте в
.
По условию процесс изобарный (). По закону Гей – Люссака:
Ошибка.
Попробуйте повторить позже
Давление газа при температуре 306 К равно 159 кПа. Газ нагрели до температуры , при этом объём газа не изменился. После
нагревания давление газа стало равно 212 кПа. Найдите, до какой температуры
нагрели газ. Ответ дайте в
кельвинах.
По условию процесс изохорный ().
Согласно закону Шарля:
Ошибка.
Попробуйте повторить позже
На графике изображено изменение состояния постоянной массы разреженного аргона. Температура газа в состоянии 2 равна
. Какова температура аргона в состоянии 1? Ответ дайте в кельвинах.

Из графика видно, что процесс 1–2 — изохорный (). Воспользуемся законом Шарля:
Переведём в кельвины:
К.
Ошибка.
Попробуйте повторить позже
На графике изображено изменение состояния постоянной массы разреженного аргона. Температура газа
в состоянии 1 равна . Какова температура аргона в состоянии 2? Ответ дайте в кельвинах.
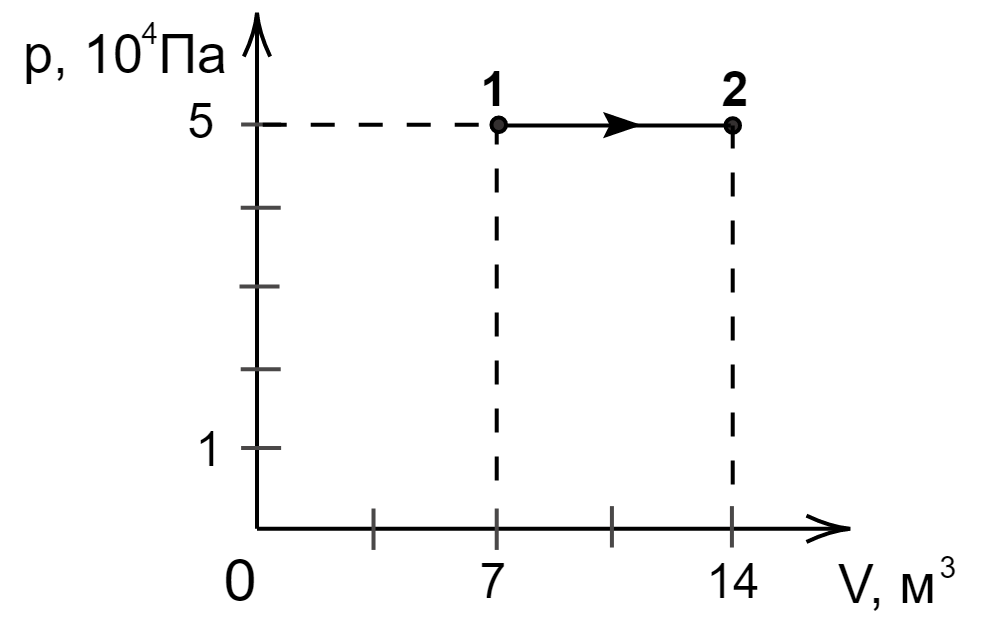
Из графика видно, что процесс 1–2 — изобарный (). Воспользуемся законом Гей –
Люссака:
Ошибка.
Попробуйте повторить позже
Воздух при температуре и давлении 202,65 кПа занимает объём
. Газ изобарно нагрели, причём объём газа увеличился
до
. Найдите конечную температуру воздуха. Ответ дайте в кельвинах.
Т.к. процесс изобарный (), используем закон Гей – Люссака:
Переведём в кельвины:
К.
Ошибка.
Попробуйте повторить позже
1 моль гелия изохорно нагревают на 154 К, при этом давление газа увеличивается в 2,1 раза. До какой температуры нагрели газ? Ответ дайте в кельвинах.
Процесс изохорный, т.е. объём не меняется. Запишем закон Шарля:
Изменение температуры есть разница конечной и начальной температуры газа:
По условию давление газа увеличивается в 2,1 раза:
Подставим (2), (3) в (1) и выразим температуру, до которой нагрели газ:
Ошибка.
Попробуйте повторить позже
Конечная температура газа в некотором процессе С. В ходе этого процесса объём идеального газа увеличился в 2 раза, а
давление не изменилось. Какова была начальная абсолютная температура газа? Ответ дайте в Кельвинах
Досрочная волна 2019
Переведем температуру в Кельвины: К.
Так как объем увеличился в 2 раза, а давление не изменилось, то по закону Шарля температура увеличилась тоже в 2 раза, значит,
начальная температура будет равна:
Ошибка.
Попробуйте повторить позже
Температура идеального газа К. Какой станет температура, если при неизменном объёме увеличить давление в 3 раза?
Ответ дайте в К.
Досрочная волна 2019
Уравнение состояния идеального газа:
где — объем газа,
— количество вещества газа,
— универсальная газовая постоянная,
— абсолютная температура
газа.
Если при неизменном объеме увеличить давление в 3 раза, то температура также возрастет в 3 раза и станет равной
К
Ошибка.
Попробуйте повторить позже
На рисунке изображено изменение состояния постоянной массы разреженного аргона. Температура газа в состоянии 1 равна 27 .
Какая температура соответствует состоянию 2? Ответ дайте в кельвинах
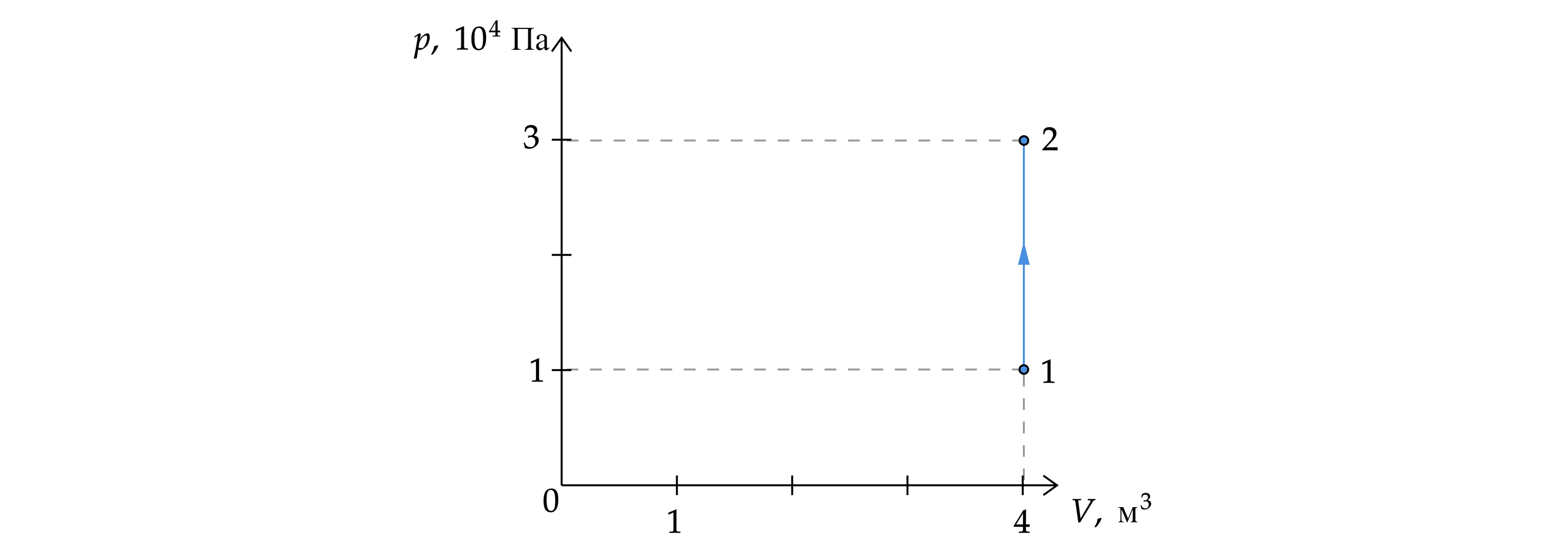
Демоверсия 2017
Переведем начальную температуру в Кельвины:
Объем постоянен, применим закон Шарля:
Откуда температура во втором состоянии:



